Avrupa Ateroskleroz Derneği (AES) Değerlendirme, Etiyoloji ve Yönetim Üzerine Uzlaşı Raporu
Uzm. Dr. Ümit Yaşar Sinan
Giriş:
Statin tedavisi, kardiyovasküler hastalıkların (KVH) hem birincil korunmasında hem de tedavisinde mihenk taşıdır. Statinlerle tedavi genellikle güvenilirdir ve iyi tolere edilir (1). Randomize kontrollü çalışmalarda statinlere bağlı yan etki sıklığı (kas ağrısını da içeren), plaseboya benzer bulunmuştur (2-4). Bununla birlikte kullanılan statine, dozuna ve eşlik eden diğer risk faktörlerine bağlı olarak bu ilaçlar nadir de olsa (sıklığı 1/1000 – 1/10000 arasında seyreden) kas semptomları ve kreatin kinaz (CK) değerlerinde normalin üst sınırının (NÜS) >10 katı artışla karakterize miyozite neden olabilirler (5). Özellikle yakın geçmişte yapılan gözlemsel çalışmalarda statinlerle ilişkili olarak kas-iskelet sistemi şikayetleri, gastointestinal rahatsızlık hissi, halsizlik, karaciğer enzim yüksekliği, periferik nöropati, insomnia ve nöro-kognitif yan etkiler ve randomize kontrollü çalışmalarda diyabet insidansında küçük bir artış bildirilmiştir (6-8). Bu yan etkiler arasında en sık görüleni, kas sistemiyle ilişkili olanlardır ve bu değerlendirmede ele alınacaktır.
Randomize kontrollü çalışmaların aksine kayıt çalışmalarında statinle ilişkili kas semptomlarının (SİKS) sıklığı, %7-29 olarak bildirilmiştir (9-13). Tedavi başlangıcından sonraki ilk 2 yıl içerisinde SİKS’na bağlı olarak çok yüksek oranlarda (yaklaşık %75) statin tedavisinin bırakıldığı görülmüştür (14). Bu tedavi uyumsuzluğunun KV korunma üzerine olumsuz etkileri görülmüştür. Bilinen KVH’ı olan yaşlı hastaların dahil edildiği bir çalışmada, düşük tedavi uyumu olan hastalarda yüksek uyumlu hastalara göre daha yüksek mortalite oranları görülmüştür (%24 & %16) (15). Yine bir meta-analizde yüksek tedavi uyumunun mortaliteyi azalttığı tespit edilmiştir (16).
Kas semptomlarının klinik olarak ortaya çıkış şekli oldukça heterojen olup; kas ağrısı, acıması, sertlik, gerginlik veya kramp şeklinde ifade edilebilir. Bu klinik tabloların hepsi birden ‘miyalji’ olarak adlandırılır. Hasta tarafından şikayetler çoğunlukla simetrik olarak tarif edilir, lokalize olabilir ve tabloya güçsüzlük eşlik edebilir. Büyük çoğunlukta CK yüksekliği tabloya eşlik etmez. Elimizdeki mevcut verilere göre, STOMP (The Effects of Statins on Muscle Performance) çalışması statinlerin kas semptomları ve performansı üzerindeki etkilerini araştıran tek randomize, çift kör ve plasebo kontrollü çalışmadır (17). Statin hiç kullanmamış 420 hastada yapılan çalışmada hastalar 80 mg atorvastatin veya plasebo grubuna randomize edilip 6 ay boyunca takip edilmişlerdir. Statin tedavisi alanların %9,4’nde, kontrol grubunun ise %4,6’sında myalji görülmüştür (p=0,054). Bu da statinlerin gözlemsel çalışmalarda bildirilenden daha az sıklıkta kas semptomlarına neden olduğunu ortaya koymuştur. Yine STOMP çalışmasında statin alanlar ile plasebo grubu arasında kas gücü ölçümlerin ve egzersiz performansı açısından fark saptanmamıştır.
Farklı çalışmalarda, herhangi bir statine bağlı kas semptomları olan hastaların diğer statinleri uzun süreli kullanımda iyi tolere ettikleri gösterilmiştir (12,18). Danimarka’da 1995-2010 yılları arasında yapılan bir araştırmada, artan statin kullanımıyla birlikte tedavi uyumsuzluğu ve ilaç bırakma sıklığının da arttığı görülmüştür (19). Medyanın statin kullanımı ve yan etkileri üzerine artan ilgisi, tedavi etkinliğinin daha az belirgin olduğu primer korunmada artan statin kullanımı bu duruma neden olabilecek faktörler arasında sayılmıştır (19).
Statinle İlişkili Kas Semptomlarının Değerlendirilmesi ve Tanısı:
Semptomların subjektif olması ve altın standart bir tanı yönteminin olmaması nedeniyle SİKS tanısını koymak güçtür. Ulusal Lipid Derneği’nin (NLA-National Lipid Association) STOMP çalışmasını ve PRIMO anketini baz alarak hazırladığı semptom skorlama sistemine rağmen, geçerliliği sınanmış bir kas semptom anketi yoktur. Tablo 1’de kas ilişkili semptomların (ağrı, güçsüzlük veya kramp) varlığına ve CK yüksekliğinin olup olmamasına göre hazırlanmış SİKS sınıflandırması yer almaktadır. Ağrı ve güçsüzlük tipik olarak simetrik, ve proksimal yerleşimlidir. Genellikle uyluklar, kalçalar, baldırlar ve sırt kasları gibi büyük kas gruplarını tutar. Güçsüzlük ve rahatsızlık hissi çoğunlukla erken dönemde (tedavi başlangıcını takiben 4-6 hafta içinde) başlar fakat tedaviden yıllar sonra da ortaya çıkabilmektedir (17). Statin dozunun artırılmasıyla veya statinlerle etkileşebilecek yeni bir ilacın tedaviye eklenmesiyle Yeni semptomlar oluşabilir. Bu semptomlar özellikle de fiziksel olarak aktif kişilerde görülmektedir. Kas ağrısına genellikle CK yükselmesi eşlik etmez. Miyopati (semptomlarla ile birlikte >10 X NÜS CK artışı) standart statin dozlarında (örneğin simvastatin 40 mg.) yılda 1/10 bin sıklığında görülmektedir. Risk farklı statinler arasında değişen oranlar göstermekte ve doz artışıyla birlikte artmaktadır (tablo 2) (21). Rabdomiyoliz, çok yüksek CK seviyeleri, miyoglobinemi ve/veya miyoglobinüriye eşlik eden artmış renal yetersizlik riskiyle karakterize, ciddi kas hasarına verilen addır. Statin kullanımıyla ilişkili rabdomiyoliz riski yıllık 1/100 bindir. Statin kullanımı sırasında CK artışı nadir görüldüğü için ve asemptomatik hafif CK artışlarının klinik anlamının belirsiz olduğu için, statin kullanan hastalarda rutin CK takibi önerilmemektedir (5).
Statinle ilişkili kas semptomları ve CK yüksekliği tedavi kesilince birkaç hafta içerisinde geriler ve ilacı tekrar başlayınca yeniden ortaya çıkar. Semptomların yeniden ortaya çıkış hızı, tekrar başlanan statin dozuna ve ara verilen süreye bağlı olarak değişmektedir.
Tablo 1. EAS Uzlaşı Paneli tarafından hazırlanan SİKS tanımlaması.
| Semptom | Biyomarker | Yorum |
Kas semptomu (+) | Normal CK | Sıklıkla miyalji olarak adlandırılır. Statin tedavisiyle ilişkili olabilir. Statin-plasebo karşılaştıran kör, randomize kontrollü çalışmaların yokluğundan nedensellik ilişkisi şüphelidir. |
Kas semptomu (+) | CK >NÜS, <4 X NÜS
CK >4 X NÜS, <10 X NÜS | Kas semptomlarına eşlik eden hafif CK artışları çoğunlukla artmış egzersiz ve fiziksel aktiviteyle ilişkilidir. Fakat statinle de ilişkili olabilir ve ciddi kas hasarı riskini artırır. |
Kas semptomu (+) | CK >10 NÜS | Miyozit veya miyopati olarak adlandırılır (kas biyopsisi veya klinik kas güçsüzlüğü olmaksızın). Çalışmalarda statine bağlı miyozit riski yıllık 1/10 bin. Ağrı yaygın ve proksimal kaslardadır. Kas güçsüzlüğü ve hassasiyeti eşlik edebilir. |
Kas semptomu (+) | CK >40 NÜS | Miyoglobüniri ve/veya renal yetersizlikle birlikte olduğunda rabdomiyoliz olarak adlandırılır. |
Kas semptomu (-) | CK >NÜS <4 X NÜS | Rastgele bulunan artmış CK düzeyi de statinlerle ilişkili olabilir. Tiroid fonksiyonları kontrol edilmeli ve ağır egzersiz ilişkisi sorgulanmalıdır. |
Kas semptomu (-) | CK >4 NÜS | Hafif asemptomatik CK artışı, CK düzeyinin rutin takip edildiği çalışmalarda saptanmıştır. Devam ederse dikkat edilmelidir. Klinik önemi belirsizdir. |
Tablo 2. SİKS’ları ile ilişkili risk faktörleri.
- Antropometrik:
- >80 yaş (>75 yaş sonrası dikkatli olunmalı)
- Kadın cinsiyet
- Düşük vücut kitle endeksi
- Asya ırkı
- Eşlik eden koşullar:
- Akut enfeksiyon
- Hipotiroidi
- Bozulmuş renal veya hepatik fonksiyon
- Safra yollarında obstrüksiyon
- Ciddi travma
- HIV
- Diyabetes mellitus
- Vitamin D eksikliği
- Cerrahi:
- AHA majör cerrahi operasyonlar öncesi statin kesilmesini önermektedir.
- İlişkili öykü:
- CK seviyesinde özellikle >10X NÜS öyküsünün varlığı
- Açıklanamayan kas, eklem, tendon ağrısının varlığı
- İnflamatuar veya kalıtımsal metabolik, nöromuskuler/kas defekti (McArdle hastalığı, karnitin palmitol transferaz II eksikliği, miyoadenilat deaminaz eksikliği ve malign hipertermi)
- Statinle ilişkili miyopati öyküsü
- Diğer lipid düşürücü ajanlarla miyopati öyküsü
- Genetik:
- Sitokrom P450 izoenziminde veya ilaç taşıyıcı sistemlerde genetik polimorfizm
- Diğer risk faktörleri:
- Aşırı fiziksel aktivite
- Diyet etkisi (aşırı greyfurt ve kızılcık suyu tüketimi)
- Aşırı alkol tüketimi
- İlaç kötüye kullanımı (kokain, amfetamin, eroin)
Statinle İlişkili Kas Semptomlarının Yönetimi:
Statin kullanan bir hasta kas semptomlarından şikayet ederse, SİKS’na neden olabilecek predispozan nedenler araştırılmalı, sekonder nedenler (özellikle hipotiroidi, polimiyalji gibi diğer miyopati nedenleri ve artmış fiziksel aktivite) dışlanmalı ve statin kullanım endikasyonu tekrar değerlendirilmelidir. Diğer sık kullanılan anti-enflamatuar (glukokortikoidler), antipsikotik (risperidon, haloperidol), immunsupresan ve anti-viral ilaçların (HIV proteaz inhibitörleri), lipid modifiye edici diğer ajanlar (gemfibrozil) ve madde kötüye kullanımının da (alkol, kokain ve opioidler) kasla ilişkili yan etkilere neden olabileceği akılda tutulmalıdır. Kadın cinsiyet, ırk, multisistem hastalığı ve küçük vücut yüzey alanı SİKS riskini artıran özelliklerdir (21-24). Farmakolojik olarak ilaç ilaç etkileşimleri de SİKS riskini artırmaktadır. Bir kez predispozan faktörler ve sekonder nedenler dışlandıktan sonra Avrupa Ateroskleroz Derneği (AES) Uzlaşı Paneli statin kullanım endikasyonunun sorgulanmasını önermektedir.
Şekil 1. SİKS’ları gelişen hastalarda izlenecek tedavi yönetim algoritmasını özetlemektedir.
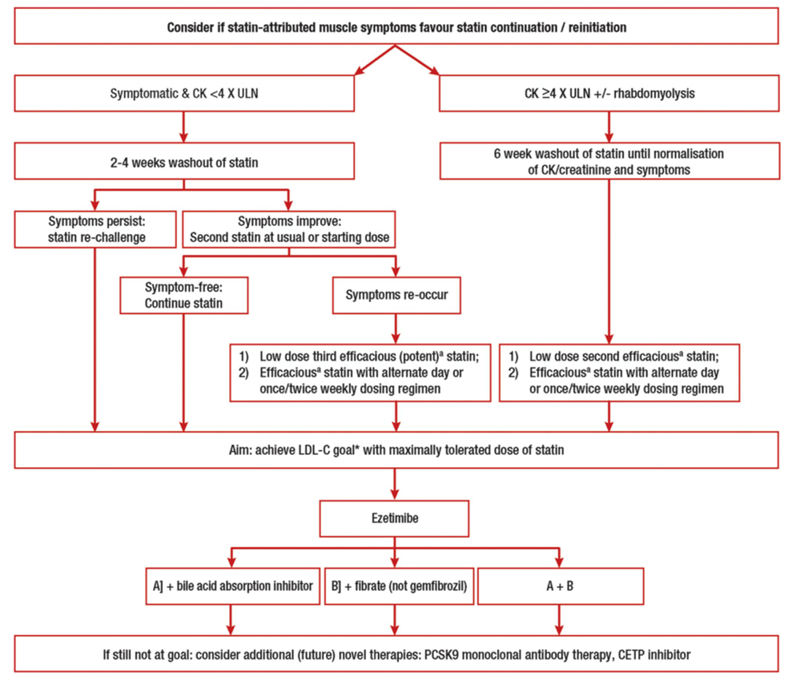
Statinle İlişkili Kas Semptomları Olan Hastalarda Güncel Tedavi Yöntemleri
- Statin bazlı tedaviler: Eğer statin tedavisi kesildikten sonra semptom/CK yüksekliği düzelirse, aynı statin daha düşük dozlarda tekrar başlanmalı veya başka bir statine geçilmelidir. Eğer hasta tolere edebilirse hedef LDL-K düzeylerine ulaşana kadar doz titre edilmeli ve kas semptomları minimalde tutulmaya çalışılmalıdır. Eğer bu strateji başarısız olursa, gün aşırı veya haftada 2 gün ilaç tedavileri hedef LDL-K düzeyini yakalayabilmek için denenmelidir. Genellikle uzun yarılanma ömrüne sahip güçlü statinlerin (atorvastatin, rosuvastatin ve pitavastatin) düşük dozları uygun tedavilerdir.
- Statin dışı lipid düşürücü ajanlar: Yüksek KVH riski olan hastalarda eğer maksimal tolere edilen dozda statin tedavisiyle hedef LDL-K seviyesine ulaşılamazsa, alternatif bir lipid düşürücü ajan tedaviye eklenebilir. Ezetimib LDL-K %15-20’i azaltırken, yan etkisi az, kullanımı kolay ve KVH riski azaltıcı etkisi gösterilmiştir (25). Ezetimib fluvastatin kombinasyonu SİKS olan hastalarda iyi tolere edilmiş ve LDL’yi %46 oranında azaltmıştır (26). Kolesevalam kullanımı kolay ve iyi tolere edilen bir safra asidi sekestresidir. Ezetimib safra asidi bağlayıcı ajan kombinasyonu LDL-K %30 azaltabilir. Fenofibrat gemfibrozilden farklı olarak rabdomiyoliz riskini artırmaz güvenilir bir ajandır ve hipertrigliseridemisi olanlarda LDL-K %15-20 azaltır (27). Niasin LDL-K %15-20 düşürür ancak randomize kontrollü çalışmalarda statin tedavisine eklenen niasin KVH sağ kalımında fayda sağlamamıştır (28,29).
- Koruyucu gıdalar: Düşük doymuş yağ tüketimi, trans yağlardan kaçınılması, yoğun lifli gıda tüketimi, bitki sterolleri ve stanollerini de içerecek şekilde beslenmek önerilmektedir ve bu önlemlerle LD-K %7-10 oranında düşer. Portofilo diyeti (bitki sterolleri, soya proteini, yoğun lif içeriği ve kabuklu yemişleri içeren) LDL-K’ü %15-20 azaltmaktadır (30).
- Tamamlayıcı tedaviler: Koenzim Q ve vitamin D başta olmak üzere çeşitli destek tedavilerinin statin tolerabilitesini artıracağı düşünülmüş ancak çalışmalarda etkinliği ispatlanmamıştır (31,32).
Statinle İlişkili Kas Semptomlarının Patofizyolojisi:
Bu konuda araştırmalar devam etmekle ve hala açıklığa kavuşturulması gereken noktalar olmakla birlikte ilgi hücre enerji tüketim yolağı ve mitokondriyal fonksiyon üzerine yoğunlaşmıştır. Statin kullanan asemptomatik hastalarda bile anormal mitokondriyal fonksiyon varlığı ve Koenzim Q düzeylerinde azalma gösterilmiştir (33). Morfometri ve in vivo manyetik yanıt spektroskopisi gibi mitokondriyal fonksiyonu inceleyen testlerle statinlerin kas mitokondrisi üzerindeki etkileri incelenebilmektedir (33). Bu gözlemlere dayanarak statinler mitokondriyal fonksiyonları baskılamakta, enerji üretimini azaltmakta, ve kas protein yıkımını etkilemektedir. Tüm bu mekanizmalar kas semptomlarının başlamasına neden olmaktadır (34). Sınırlı sayıda SİKS olan hastayı içeren kas biyopsisi çalışmalarında da anormal mitokondriyal fonksiyon gösterilmiştir. Aksine diğer bazı çalışmalarda SİKS ve CK yüksekliği olan hastalarda kas biyopsileri negatif sonuçlanmıştır (35). Totalde tüm bu bulgular ışığında SİKS’larının altında yatan patofizyolojik mekanizma aşikar değildir (36).
Statinle İlişkili Kas Semptomlarına Genetik Duyarlılık:
Statinle ilişkili miyopatide genetik testlerin kullanımı henüz yaygın olmamakla birlikte, hem karaciğer hem de iskelet kasında semptomlara neden olacak düzeyde kan statin konsantrasyonunu artıran, ilaç transportuyla ilişkili genlerde bazı genetik mutasyonlar saptanmıştır (37-39). Kas hastalığı için aile öyküsü olan ve SİKS geliştiren hastalarda genotiplendirme önerilmektedir. Tedavi sonrası >6 ay SİKS devam eden hastalarda da genetik test önerilmektedir.
Sonuç:
Statin tedavisiyle LDL-K’ün düşürülmesi KVH gelişimini %40 oranında azaltmaktadır. Statin kullanımına bağlı gelişen yan etkiler özellikle de kas semptomları, statin uyumsuzluğu veya tedavi bırakılmasının en sık nedenidir ve statinlerin KVH’lar üzerindeki faydalı etkisini azaltmaktadır. Altın standart bir tanımlamanın olmaması nedeniyle EAS Uzlaşı Paneli SİKS olasılığını, semptomların doğası üzerine statin etkisini, semptomların statin başlanmasıyla olan direk ilişkisini, ilaç bırakma ve yeniden başlamayla semptomların kaybolmasını ve yeniden ortaya çıkmasını baz almayı önermektedir. Yine Uzlaşı Paneli SİKS gelişiminin patofizyolojisini anlayabilmek için ileri araştırmalara gereksinim olduğunu vurgulamaktadır.
Kaynaklar:
1. Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, et al. ESC/EAS guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011; 32: 1769–818.
2. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet. 2002; 360: 7–22.
3. Ridker PM, Danielson E, Fonseca FA, Genest J, Gotto AM Jr, Kastelein JJ, et al; JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008; 359: 2195–207.
4. Kashani A, Phillips CO, Foody JM, Wang Y, Mangalmurt iS, Ko DT, et al. Risks associated with statin therapy: a systematic overview of randomized clinical trials. Circulation. 2006; 114: 2788–97.
5. Law M, Rudnicka AR. Statin safety: a systematic review. Am J Cardiol 2006;97: 52C – 60C.
6. Carter AA, Gomes T, Camacho X, Juurlink DN, Shah BR, Mamdani MM. Risk of incident diabetes among patients treated with statins: population based study. BMJ. 2013; 346: 2610.
7. Mancini GB, Tashakkor AY, Baker S, Bergeron J, Fitchett D, Frohlich J, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: Canadian Working Group Consensus update. Can J Cardiol. 2013; 29: 1553-68.
8. Richardson K, Schoen M, French B, Umscheid CA, Mitchell MD, Arnold SE, et al. Statins and cognitive function: a systematic review. Ann Intern Med. 2013; 159: 688-97.
9. Bruckert E, Hayem G, Dejager S, Yau C, Begaud B. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients—the PRIMO study. Cardiovasc Drugs Ther. 2005; 19: 403–14.
10. Buettner C, Rippberger MJ, Smith JK, Leveille SG, Davis RB, Mittleman MA. Statin use and musculoskeletal pain among adults with and without arthritis. Am J Med. 2012; 125: 176–82.
11. Cohen JD, Brinton EA, Ito MK, Jacobson TA.Understanding statin use in America and gaps in patient education (USAGE): an internet-based survey of 10,138 current and former statin users. J Clin Lipidol. 2012; 6: 208–15.
12. Zhang H, Plutzky J, Skentzos S, Morrison F, Mar P, Shubina M, et al. Discontinuation of statins in routine care settings: a cohort study. Ann Int Med. 2013; 158: 526–534.
13. El-Salem K, Ababeneh B, Rudnicki S, Malkawi A, Alrefai A, Khader Y, et al. Prevalence and risk factors of muscle complications secondary to statins. Muscle Nerve. 2011; 44: 877– 81.
14. Chodick G, Shalev V, Gerber Y, Heymann AD, Silber H, Simah V, et al. Long- term persistence with statin treatment in a not-for-profit health maintenance organization: a population-based retrospective cohort study in Israel. Clin Ther. 2008; 30: 2167–79.
15. Jackevicius CA, Mamdani M, Tu JV. Adherence with statin therapy in elderly patients with and without acute coronary syndromes. JAMA. 2002; 288: 462–7.
16. Chowdhury R, Khan H, Heydon E, Shroufi A, Fahimi S, Moore C, et al. Adherence to cardiovascular therapy: a meta-analysis of prevalence and clinical consequences. Eur Heart J. 2013; 34: 2940–48.
17. Parker BA, Capizzi JA, Grimaldi AS, Clarkson PM, Cole SM, Keadle J, et al. Effect of statins on skeletal muscle function. Circulation. 2013; 127: 96–103.
18. Mampuya WM, Frid D, Rocco M, Huang J, Brennan DM, Hazen SL, et al. Treatment strategies in patients with statin intolerance: the Cleveland Clinic experience. Am Heart J. 2013; 166: 597–603.
19. Nielsen SF, Nordestgaard BG. Statin use before diabetes and risk of microvascular disease: a nationwide nested matched study. Lancet Diabet Endocrinol. 2014; 2: 894–900.
20. Rosenson RS, Baker SK, Jacobson TA, Kopecky SL, Parker BA. An assessment by the statin muscle safety task force: 2014 update. J Clin Lipidol. 2014; 8: 558–71.
21. Armitage J. The safety of statins in clinical practice. Lancet. 2007; 370: 1781–90.
22. Corsini A. The safety of HMG-CoA reductase inhibitors in special populations at high cardiovascular risk. Cardiovasc Drugs Ther. 2003; 17: 265–85.
23. Armitage J, Baigent C, Collins R. Misrepresentation of statin safety evidence. Lancet. 2014; 384: 1263–4.
24. Ahmad Z. Statin intolerance. Am J Cardiol. 2014; 113: 1765–71.
25. Cannon CP, IMPROVE-IT Investigators. IMProved Reduction of Outcomes: Vytorin Efficacy International Trial. A multicenter, double-blind, randomized study to establish the clinical benefit and safety of Vytorin (ezetimibe/simvastatin tablet) vs simvastatin monotherapy in high-risk subjects presenting with acute coronary syndrome.http://my.americanheart.org/idc/groups/ahamahpublic/@wcm/@sop/@scon/documents/downloadable/ucm_469669.pdf (22 November 2014).
26. Stein EA, Ballantyne CM, Windler E, Sirnes PA, Sussekov A, Yigit Z, et al. Efficacy and tolerability of Fluvastatin XL 80 mg alone, ezetimibe alone and the combination of Fluvastatin XL 80 mg with ezetimibe in patients with a history of muscle-related side effects with other statins: a randomized, double- blind, double-dummy trial. Am J Cardiol. 2008; 101: 490–6.
27. ACCORD Study Group, Ginsberg HN, Elam MB, Lovato LC, Crouse JR III, Leiter LA, Linz P, et al. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med. 2010; 362: 1563–74.
28. AIM-HIGH Investigators, Boden WE, Probstfield JL, Anderson T, Chaitman BR, Desvignes-Nickens P, Koprowicz K, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med. 2011; 365: 2255–67.
29. HPS2-THRIVE Collaborative Group. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J 2013; 34: 1279–91.
30. Jenkins DJ, JonesPJ, Lamarche B, Kendall CW, Faulkner D, Cermakova L, et al. Effect of a dietary portfolio of cholesterol-lowering foods given at 2 levels of intensity of dietary advice on serum lipids in hyperlipidemia: a randomized controlled trial. JAMA. 2011; 306: 831–9.
31. Taylor BA, Lorson L, White CM, Thompson PD. A randomized trial of Coenzyme Q10 in patients with confirmed statin myopathy. Atherosclerosis. 2015; 238: 329–35.
32. Michalska-Kasiczak M, Sahebkar A, Mikhailidis DP, Rysz J, Muntner P, Toth PP, et al.; Lipid and Blood Pressure Meta-analysis Collaboration (LBPMC) Group., Lipid and Blood Pressure Meta-analysis Collaboration (LBPMC) Group. Analysis of vitamin D levels in patients with and without statin-associated myalgia – a systematic review and meta-analysis of 7 studies with 2420 patients. Int J Cardiol. 2014; 178C: 111–6.
33. Vladutiu GD, Simmons Z, Isackson PJ, Tarnopolsky M, Peltier WL, Barboi AC, et al. Genetic risk factors associated with lipid-lowering drug-induced myopathies. Muscle Nerve. 2006; 34: 153–62.
34. Mikus CR, Boyle LJ, Borengasser SJ, Oberlin DJ, Naples SP, Fletcher J, et al. Simvastatin impairs exercise training adaptations. J Am Coll Cardiol. 2013; 62: 709– 14.
35. Mohaupt MG, Karas RH, Babiychuk EB, Sanchez-Freire V, Monastyrskaya K, Iyer L, et al. Association between statin-associated myopathy and skeletal muscle damage. CMAJ. 2009; 181: E11–E18.
36. Lamperti C, Naini AB, Lucchini V, Prelle A, Bresolin N, Moggio M, et al. Muscle coenzyme Q10 level in statin-related myopathy. Arch Neurol. 2005; 62: 1709–12.
37. Knauer MJ, Urquhart BL, Meyer zu Schwabedissen HE, Schwarz UI, Lemke CJ, Leake BF, et al. Human skeletal muscle drug transporters determine local exposure and toxicity of statins. Circ Res. 2010; 106: 297–306.
38. Bersot T. Drug therapy for hypercholesterolemia and dyslipidemia. In: Brunton LL, Chabner BA, Knollmann BC, eds. Goodman & Gilman’s The Pharmacological Basis of Therapeutics. 12th ed. New York: McGraw-Hill; 2011, p877 – 905.
39. DeGorter MK, Tirona RG, Schwarz UI, Choi YH, Dresser GK, Suskin N, et al. Clinical and pharmacogenetic predictors of circulating atorvastatin and rosuvastatin concentrations in routine clinical care. Circ Cardiovasc Genet. 2013; 6: 400–8.