|
Kalp Yetersizliği ÇG
Yönetim Kurulu
Başkan:
Dr. Özlem Yıldırımtürk
Y.K. adına Koordinatör:
Dr. Dursun Aras
Y.K. adına Koordinatör:
Dr. Bülent Mutlu
Üyeler
Dr. K. Emre Aslanger
Dr. Zübeyde Bayram
Dr. Ali Kemal Kalkan
Dr. Hakkı Kaya
Dr. Taner Şen
Katkıda Bulunanlar
Dr. Anıl Şahin
Dr. Çağatay Tunca
Dr. Selvi Öztaş
Dr. Selda Murat
Dr. Uğur Özpınar
Dr. Duygu İnan
Dr. Bektaş Murat
Dr. Çetin Alak
Dr. Orhan Furkan Karaca
Dr. Etkin Elifoğlu
Dr. Ufuk Yıldız
Dr. İnci Tuğçe Çöllüoğlu
Dr. Yusuf Ziya Şener
|
|
Geçmiş anket sonuçları
Bülten İstek Formu
|
 
KY Bülteni - HELIOS-B Çalışması: Vutrisiran ATTR Amiloid Kardiyomiyopatisinde Sağkalımı İyileştiriyor ve Kardiyovasküler Olayları Azaltıyor
<br>
Vutrisiran Reduces All-Cause Mortality (Dr. Duygu İnan)HELIOS-B Çalışması: Vutrisiran ATTR Amiloid Kardiyomiyopatisinde Sağkalımı İyileştiriyor ve Kardiyovasküler Olayları Azaltıyor
Vutrisiran Reduces All-Cause Mortality
Dr. Duygu İnan
HELIOS-B Çalışması: Vutrisiran ATTR Amiloid Kardiyomiyopatisinde Sağkalımı İyileştiriyor ve Kardiyovasküler Olayları Azaltıyor
Vutrisiran Reduces All-Cause Mortality
Dr. Duygu İnan
Son on yılda transtiretin amiloid kardiyomiyopatisine (ATTR-CM) yönelik terapötik seçeneklerde büyük bir ilerleme yaşanmıştır. Normalde karaciğerde sentezlenen transtiretin (TTR) proteini stabil bir tetramer yapısında bulunur. Ancak genetik mutasyonlarla (ATTRv-CM) ya da yaşlanmayla (ATTRwt-CM) bu yapı bozulur ve toksik monomerler ile fibriller oluşarak kalp dokusunda birikir. Geçmişte tedavi organ nakli ile sınırlıyken, günümüzde karaciğerde üretilen TTR tetramerlerini stabilize eden ajanlar ve karaciğerden TTR üretimini baskılayan farmakolojik gen susturma ajanlarından oluşan farklı tedavi yöntemleri geliştirildi ve geliştirilmeye devam etmektedir. 2025’te HELIOS-B çalışmasının yayımlanmasının ardından vutrisiran, ATTR-CM tedavisi için onay aldı.
Vutrisiran, cilt altından uygulanan bir RNA interferans tedavisidir ve Faz 3 HELIOS-B çalışmasının (ATTR-CM Olan Hastalarda Vutrisiran’ın Değerlendirilmesi; NCT04153149) sonuçları, vutrisiran’ın tüm nedenlere bağlı ölüm (TNM) ve kardiyovasküler (KV) olaylardan oluşan birleşik sonlanım noktasına yönelik riski, ATTR-CM (ATTRwt veya ATTRv) hastalarında plaseboya kıyasla azalttığını göstermiştir.
TNM için önceden belirlenmiş analizler, 33 ila 36 aylık çift kör (ÇK) dönem verileri ile bu döneme ek olarak 6 aya kadar olan takip verilerini (39-42 aya kadar) kullanmıştır.
Witteles ve ark yayınladığı bu çalışmada ise, daha önce yayımlanan birincil analizde kullanılan veri kesitinden (8 Mayıs 2024; hastaların %42.4’ü 42 aylık takip verisine sahipti) daha güncel bir veri kesiti (22 Kasım 2024; hastaların %96.3’ü 42 aylık veriye sahipti) kullanılarak ölüm sonuçları raporlanmıştır.Bu sayede, ek 6 aylık takip süresiyle daha fazla olaya dair veri dahil edilmiştir. Ayrıca, ÇK döneminde vutrisiran tedavisinin KV hastaneye yatışlar ve kalp yetersizliği (KY) olayları üzerindeki etkilerine ilişkin post hoc analiz sonuçları da sunulmuştur.
Helios B çalışmasında, 18 ila 85 yaş aralığında, ATTR-CM (ATTRwt veya ATTRv) tanısı almış ve KY öyküsü olan hastalar, 1:1 oranında randomize edilerek 3 ayda bir cilt altı yolla uygulanan 25 mg vutrisiran veya plasebo almak üzere en fazla 36 ay boyunca tedaviye alınmışlardır. Hastalar başlangıçta tafamidis kullanıyor ya da kullanmıyor olabilirlerdi ve randomizasyondan sonraki 12 ay içinde tafamidis başlanmasına yönelik önceden belirlenmiş bir plan mevcut değildi. Başlangıçta tafamidis kullanmayan hastalara, araştırmacı gerekli görürse çalışmaya katıldıktan sonra gerekli gördüğü herhangi bir zamanda tafamidis tedavisi ekleyebiliyordu. ÇK dönemi (33 ila 36 ay) tamamlayan hastalar, 3 ayda bir 25 mg vutrisiran almaya devam edecekleri 24 aya kadar kadar olan açık etiketli uzatma fazına alınmaya uygun kabul edildiler.
Bu güncel analizde, Helios- B çalışması için önceden belirlenmiş TNM ve KV mortalite (kalp nakli ve sol ventrikül destek cihazı yerleştirilmesi dahil) sonlanım noktaları, birincil analizde kullanılan veri kesitinden daha güncel bir veri seti ile birlikte değerlendirilmiştir. Ayrıca, KV hastaneye yatışlar, KY hastaneye yatışları, aritmi nedeniyle yatışlar, acil KY başvuruları ve KV mortalite ile KV olayların birleşik sonlanım noktası dahil olmak üzere ilave KV olay analizleri yapılmıştır. Analizler hem tüm hasta popülasyonunda hem de başlangıçta tafamidis kullanmayan hastalardan oluşan monoterapi grubunda gerçekleştirilmiştir. Başlangıçta tafamidis kullanan hastalardan oluşan alt grup (tafamidis alt grubu) için de analiz yapılmıştır; ancak bu alt grup analizinin, tedavi grupları arasında fark saptayacak yeterli istatistiksel güce sahip olmadığı da belirtilmiştir.
Randomize edilen 655 hastanın 326’sının vutrisiran, 328’nin plasebo aldığı ve 1 hastanın ise hiçbir çalışma ilacı almadığı tespit edildi. Vutrisiran veya plasebo alan hastalardan, sırasıyla %60,1 ve %60,7’si başlangıçta tafamidis almıyordu ve bu grup “monoterapi popülasyonu”nu oluşturuyordu; ve yine sırasıyla %39,9 ve %39,3’ü tafamidis alıyordu ve bu da “başlangıç tafamidis alt grubu” olarak tanımlanmıştı.
Vutrisiran tedavisi, genel popülasyonda 42 aya kadar TNM riskini %36 oranında azalttığı tespit edildi (HR: 0.64; %95 GA: 0.460.88; P = 0.01; 42. ayda olay oranları [SE]: plasebo 28.95 [2.55]; vutrisiran 18.36 [2.21]). Monoterapi popülasyonunda bu azalma %39 oranındaydı (HR: 0.61; %95 GA: 0.420.90; P = 0.02). Başlangıçta tafamidis alan alt grupta benzer bir eğilim gözlenmekle birlikte, istatistiksel olarak anlamlı olmadığı görüldü (HR: 0.66; %95 GA: 0.371.20; P = 0.22).
KV mortalite riski, vutrisiran genel popülasyonda %33 oranında azaltırken (HR: 0.67; %95 GA: 0.470.96; P = 0.04; 42. ayda olay oranları: plasebo 22.70 [SE: 2.40]; vutrisiran 14.96 [SE: 2.07]), monoterapi popülasyonunda bu azalma %36 tespit edildi (HR: 0.64; %95 GA: 0.410.98; P = 0.05). Başlangıç tafamidis alt grubunda da numerik olarak daha düşük risk gözlendi, ancak istatiksel anlamlı olamadığı görüldü (HR: 0.75; %95 GA: 0.381.47; P = 0.42).
KV mortalite ve KV olayların bileşik sonlanımında, vutrisiran tedavisinin genel popülasyonda riski %28 oranında azalttığı (HR: 0.72; %95 GA: 0.550.94; P = 0.02; 100 hasta-yıl başına olay: plasebo 34.18 [SE: 5.96]; vutrisiran 24.77 [SE: 6.77]), monoterapi popülasyonunda ise bu azalmanın %32 (HR: 0.68; %95 GA: 0.490.95; P = 0.02) olduğu görüldü. Başlangıç tafamidis alt grubunda da benzer ama istatistiksel olarak anlamlı olmayan bir eğilim mevcut olduğu tespit edildi (HR: 0.78; %95 GA: 0.501.22; P = 0.28).
Genel popülasyonda, vutrisiran grubunun %34.4’ü 3336 ay içinde toplam 200 yineleyen KV olay yaşarken, plasebo grubunun %40.5’i 263 olay yaşadığı tespit edildi. Bu sonuçlar, %27 oranında azalma anlamına gelmektedir (RR: 0.73; %95 GA: 0.610.88; P < 0.001). Benzer şekilde, monoterapi popülasyonunda vutrisiran KV olay oranını %32 azalttığı (RR: 0.68; %95 GA: 0.530.86; P < 0.01) tespit edildi. Başlangıç tafamidis alt grubunda da benzer ama anlamlı olmayan bir azalma gözlendi (RR: 0.83; %95 GA: 0.611.11; P = 0.21).
KV hastaneye yatışlarda ise, genel popülasyonda %25 (RR: 0.75; %95 GA: 0.620.91; P < 0.01), monoterapi grubunda %34 azalma (RR: 0.66; %95 GA: 0.510.86; P < 0.01) olduğu gözlendi. Başlangıç tafamidis grubunda azalma gözlense de istatistiksel olarak anlamlı değildi (RR: 0.89; %95 GA: 0.651.21; P = 0.46).
KY ile hastaneye yatışlar da ise genel popülasyonda %33 (RR: 0.67; %95 GA: 0.520.86), monoterapi popülasyonunda %38 azalma (RR: 0.62; %95 GA: 0.450.86) tespit edildi. Başlangıç tafamidis grubunda ise yanlızca nümerik bir azalma gözlendi (RR: 0.75; %95 GA: 0.491.14; P = 0.18).
Acil servise KY ile baş vuruda, genel popülasyonda %46 azalma (RR: 0.54; %95 GA: 0.300.98; P = 0.04), monoterapi (RR: 0.76; %95 GA: 0.401.42; P = 0.39).ve tafamidis alt grubunda (RR: 0.38; %95 GA: 0.121.149; P = 0.10) yanlızca nümerik bir azalma tespit edildi.
Aritmi ile yatışlarda, vutrisiran lehine eğilim olsa da hiçbir grupta istatistiksel olarak anlamlı fark saptanmadığı görüldü (genel popülasyon: RR: 0.86; P = 0.55, monoterapi: RR: 0.77; P = 0.43, tafamidis grubu: RR: 0.96; P = 0.91).
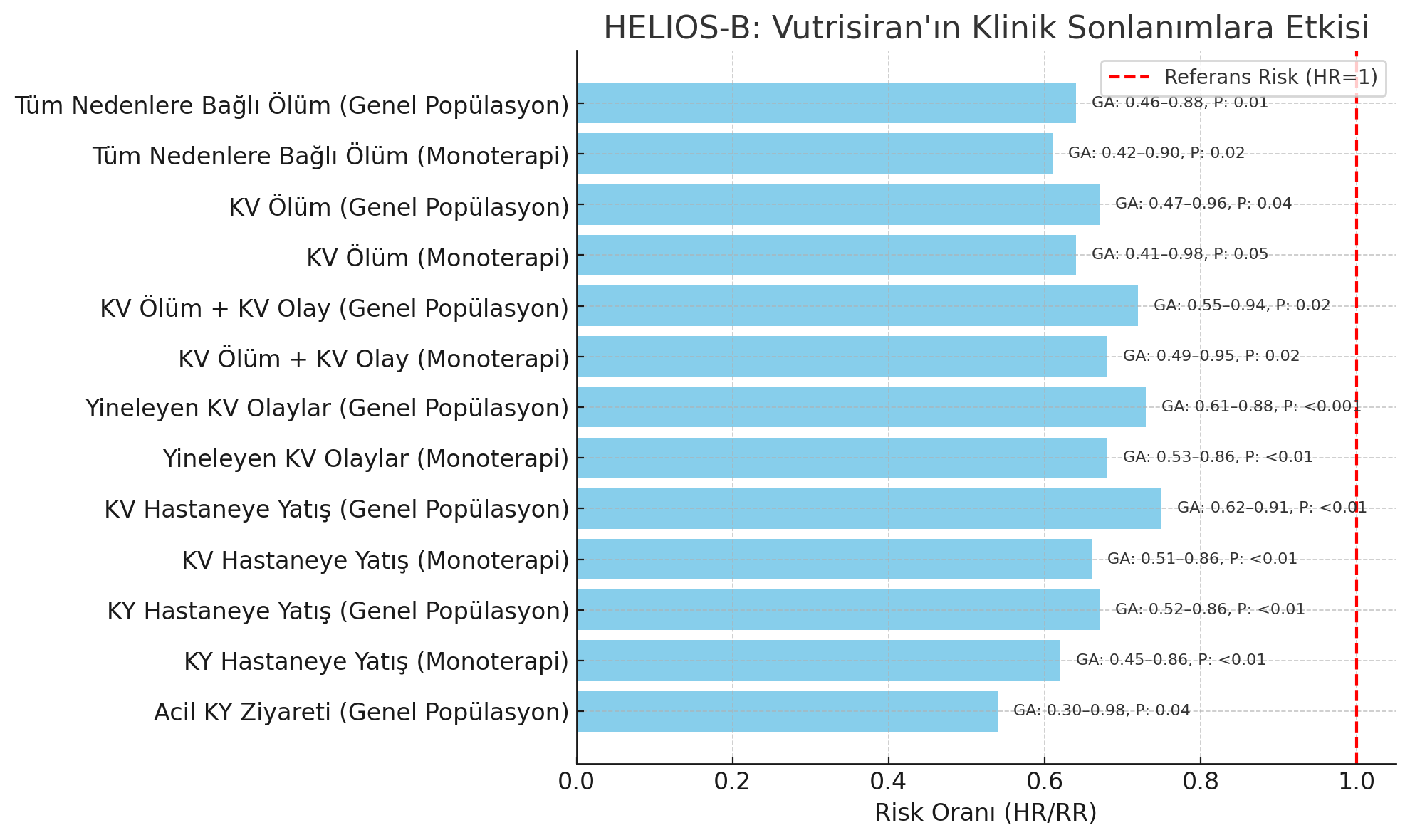
Şekil 1. Genel popülasyon ve monoterapi grubunda Vutrisiran’nın klinik sonlanımlara etkisi.
HELIOS-B çalışması, Vutrisiran’ın ATTR-CM hastalarında mortalite ve morbiditeyi anlamlı şekilde azalttığını göstermektedir. Dahası bu çalışma, tafamidis ile sağlanan faydanın ötesine geçen, klinik olarak anlamlı bir mortalite azalması göstermesi açısından dikkat çekicidir. ATTR-ACT çalışmasında tafamidis ile sağlanan mortalite azalması %30 civarında iken, vutrisiran’ın benzer hasta popülasyonunda daha düşük olay oranlarına ulaşması tedavi paradigmasını değiştirebilir niteliktedir. Bu faydalar, tafamidis kullanmayan hastalarda daha belirgin olup, ileri kalp yetersizliği evresine sahip olanlar (NYHA sınıf III) dahil çeşitli alt gruplarda da saptanmıştır. Acil kalp yetersizliği başvurularındaki dramatik azalma, tedavinin klinik etkinliğini güçlendirmektedir. Vutrisiran, tafamidis ve acoramidis’in ardından ATTR-CM tedavisinde önemli bir yer edinmiştir. Çalışma ayrıca, ATTR-CM’de tedavi faydalarının zaman içinde belirginleştiğini ve hastalığın erken döneminde tedaviye başlamanın önemini vurgulamaktadır. Ancak yazarlar, tafamidis ile kombinasyon tedavisinin henüz desteklenmediğini, bu alt grup analizinin randomize olmaması nedeniyle dikkatli yorumlanması gerektiğini vurgulamaktadır. Bu sonuçlar ile kombinasyon tedavilerinin yeri ve uzun vadeli maliyet-etkinlik analizleri gibi sorular halen yanıt beklemektedir. Gelecekte yapılacak kafa kafaya karşılaştırmalı ve farmakoekonomik çalışmalar (örneğin CARDIO-TTRansform çalışması) tedavi algoritmalarının daha net belirlenmesine yardımcı olacaktır.

|


