|
 |
| Kalp Yetersizliği Elektronik Haber Bülteni Yıl: 14 Sayı: 3 / 2022 |
Geçmiş anket sonuçları Bülten İstek Formu |
2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS) Dr. Yusuf Ziya Şener Dr. Yusuf Ziya Şener Beypazarı Devlet Hastanesi Kardiyoloji Bölümü Giriş Kanser tedavisindeki gelişmelere bağlı olarak kanser hastalarının sağkalım sürelerinin uzaması ve yeni geliştirilen tedavi ajanların kardiyotoksik etkileri nedeni ile günlük kardiyoloji pratiğinde kardiyologlar kanser hastaları ile çok sık karşılaşmaktadırlar. Antrasiklin kardiyotoksisitesi ile farkındalık oluşmaya başladıktan sonra HER-2 bazlı tedaviler, tirozin kinaz inhibitörleri ve immün kontrol noktası (checkpoint) inhibitörleri ilişkili kardiyovasküler toksisiteler tanımlanmış olup bu gelişmeler Kardiyo-Onkoloji disiplininin oluşmasına neden olmuştur. Avrupa Kardiyoloji Derneği (ESC) ilk kez 2016 yılında bir görüş raporu yayınlamış olup bu sene 2022 ESC Kongresinde ilk Kardiyo-Onkoloji kılavuzunu yayınlamıştır. Bu metinde kılavuzun kalp yetersizliği ile ilgili olan kısımları özetlenmiştir. Risk Değerlendirme Kanser tedavisi planlanan hastalarda risk sınıflaması yapılması önerilmektedir. Kalp Yetersizliği Cemiyeti (HFA) ve Uluslararası Kardiyo-Onkoloji Derneği (IC-OS) ortaklığı ile tedavi ajanına yönelik; hastanın bazal kardiyovasküler risk faktörleri, sol ventrikül ejeksiyon fraksiyonu, yaş ve bazal kardiyak biyobelirteçleri içeren HFA-ICOS risk sınıflaması geliştirilmiştir. Hiçbir risk faktörü olmayan hastalar düşük risk grubunda tanımlanmış olup, bu hastalara rutin onkolojik takip ve takipte kardiyotoksisite gelişirse kardiyoloji konsültasyonu önerilmektedir. Orta risk grubunda, yakın onkolojik takip ve yine takipte kardiyotoksisite gelişirse kardiyoloji konsültasyonu önerilmektedir. Ancak yüksek ve çok yüksek risk grubundaki hastaların tedavi öncesinde kardiyolojiye yönlendirilmesi ve kardiyologların da tedavi sürecinin planlanmasında aktif rol alması önerilmektedir. Bütün hastalara tedavi öncesi öykü ve fizik muayene ile kardiyovasküler değerlendirme yapılmalı ve EKG çekilmelidir. Tedavi öncesi bazal ekokardiyografi yapılmasına ve serum biyobelirteçlerinin istenmesine, uygulanacak kanser tedavisine ve hastanın risk sınıfına göre karar verilmelidir. Kanser Tedavisi İlişkili Kalp Yetersizliği Sınıflaması Kanser tedavisi ilişkili kalp yetersizliği sınıflaması, hastaların semptomatik olmasına ve sol ventrikül ejeksiyon fraksiyonuna göre yapılmıştır (Tablo-1).
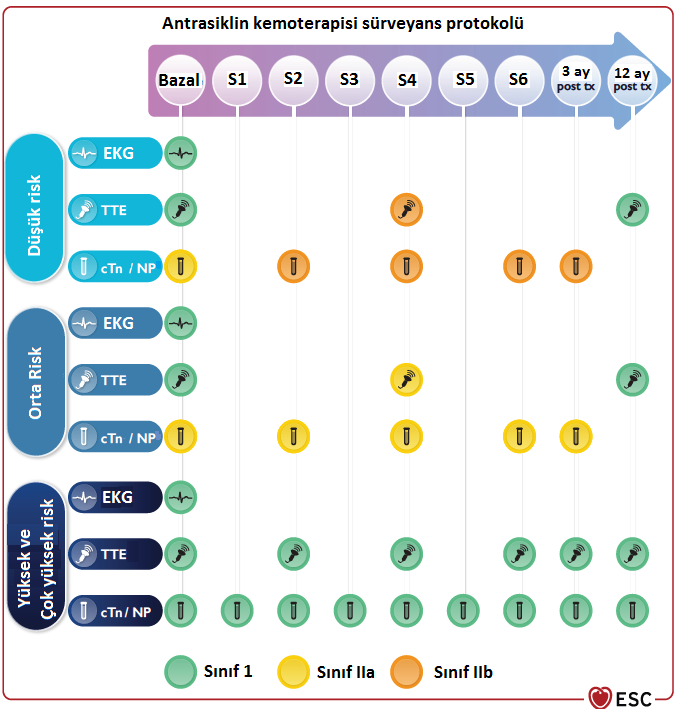
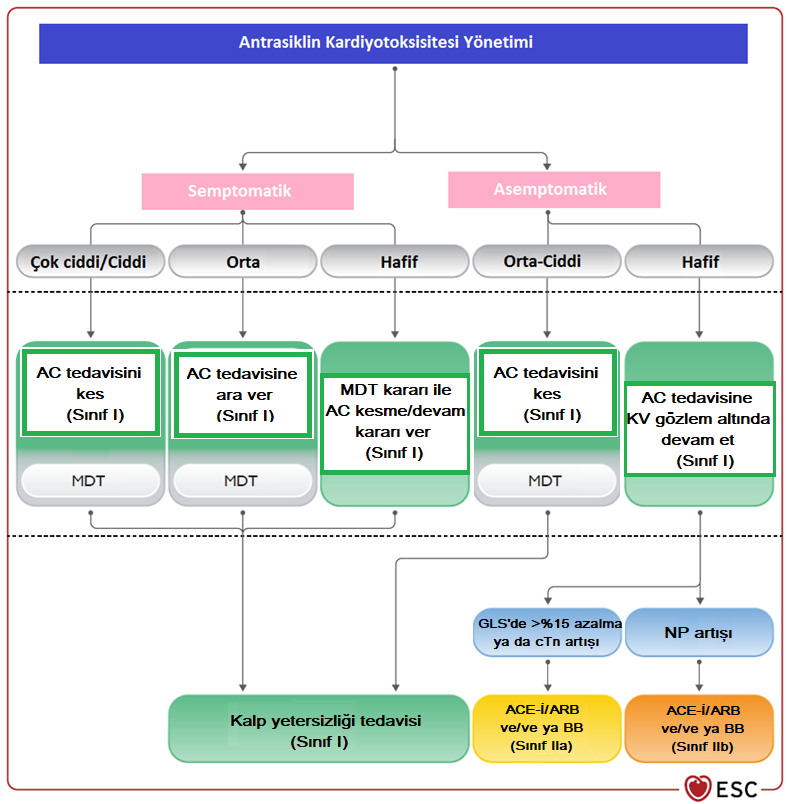
Kanser tedavisi sürecinde toksisite sürveyansı için tedavi ajanlarına yönelik protokoller geliştirilmiş olup bundan sonraki kısımda kalp yetersizliğine neden olan ve kardiyologların en sık karşılaştığı tedaviler ile ilgili sürveyans protokolleri ve kardiyotoksisite yönetimi sunulmuştur. Antrasiklin Toksisitesi Antrasiklinler kanser tedavisinde kullanılan temel ilaçlardandır. Daunorubisin, idarubisin, doksorubisin ve epirubisin antrasiklin grubu kemoterapi ajanlarıdır. Hematolojik maligniteler, meme kanseri, sarkomlar ve mide kanserinde kullanılmaktadırlar. Antrasiklin ilişkili kardiyotoksisite temel olarak sistolik disfonksiyon ve kalp yetersizliği ile prezente olur ve kümülatif doz ile ilişkilidir. Tedaviye başlamadan önce bazal ekokardiyografik değerlendirme bütün hastalara önerilmektedir. Kardiyotoksisite takibinde 3D ölçüm ile ejeksiyon fraksiyonu değerlendirilmesi ve global longitudinal strain (GLS) takibi önerilmektedir. GLS ölçümü subklinik toksisitenin belirlenmesinde önemli olup bazal değerine göre %15 azalma olması kardiyotoksisite için anlamlıdır. Çok yüksek ve yüksek riskli hastalarda sınıf I endikasyonla; orta ve düşük riskli hastalarda ise sınıf IIa endikasyon ile tedavi öncesi bazal troponin ve natriüretik peptit düzeyi ölçülmesi önerilmektedir. Antrasiklin kardiyotoksisitesi sürveyansında önerilen tetkik ve zamanlamaları Şekil-1de gösterilmiştir. Antrasiklin tedavisine devam etmenin elzem olduğu ancak toksisite gelişmiş, toksisite için eşik kümülatif doz değerine yaklaşmış ya da yüksek ve çok yüksek risk grubundaki hastalarda antrasiklin tedavisinden 30 dakika önce iv deksrazoksan (Doz oranı: deksrazoksan/daunorubisin=10/1) uygulaması ya da antrasiklininlipozomal formunun tercih edilmesi toksisite riskini azaltmada etkilidir. Semptomatik antrasiklin toksisitesi varlığında kılavuza uygun kalp yetersizliği tedavisi (ACE inhibitörü/ARB ya da ARNI, mineralokortikoid reseptör antagnoisti, beta blokörler ve SGLT-2 inhibitörleri) başlanmalıdır. Orta ve üzeri semptomatik kalp yetersizliği toksisitesi geliştiğinde antrasiklin kesilmelidir. Hafif semptomatik kalp yetersizliği varlığında antrasikline devam edilmesine multidisipliner kardiyoonkoloji takımı tarafından karar verilmelidir. Asemptomatik kalp yetersizliği toksisitesi varlığında ise; hafif toksisite varsa kardiyovasküler monitörizasyon altında antrasiklin tedavisine devam edilebilir ve bu hastalara ACE inhibitörü/ARB ve beta blokör başlanması önerilmektedir. Orta ve ciddi asemptomatik kalp yetersizliği geliştiğinde antrasiklin tedavisine ara verilmesi ve kılavuz temelli kalp yetersizliği tedavisi başlanması gerekmektedir (Şekil-2).
Şekil-1. Antrasiklin kemoterapisi alan hastalarda kardiyotoksisite takip şeması Kısaltmalar: S1: Birinci siklus, Post tx: Tedavi sonrası, EKG: Elektrokardiyografi, TTE: Transtorasik ekokardiyografi, cTn: Kardiyak troponin, NP: Natriüretikpeptit
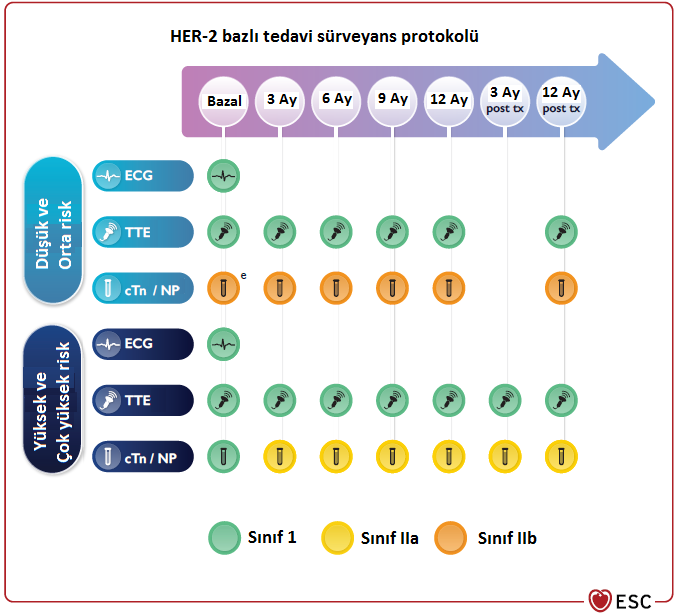
Şekil-2. Antrasiklin kardiyotoksisitesi yönetimi Kısaltmalar: AC: Antrasiklin, KV: Kardiyovasküler, MDT: Multidisipliner takım, GLS: Global longitudinalstrain, cTn: Kardiyak troponin, NP: Natriüretik peptit, ACE-İ: ACE inhibitörü, ARB: Anjiyotensin reseptör blokörü, BB: Beta blokör HER 2 Bazlı Tedavi Kardiyotoksisitesi HER-2 inhibitörleri (Trastuzumab, lapatinib, TDM-1 vb.), meme kanseri ve mide kanseri tedavisinde kullanılan ajanlardır. HER-2 inhibitörleri kalp yetersizliğine neden olabilirler ve antrasiklin ilişkili toksisiteden farklı olarak HER-2 inhibitörü toksisitesi dozdan bağımsızdır ve ilaç kesildikten sonra genellikle geri dönüşümlüdür. HER-2 inhibitörü kullanan hastalarda kardiyotoksisite sürveyansı Şekil-3te özetlenmiştir.
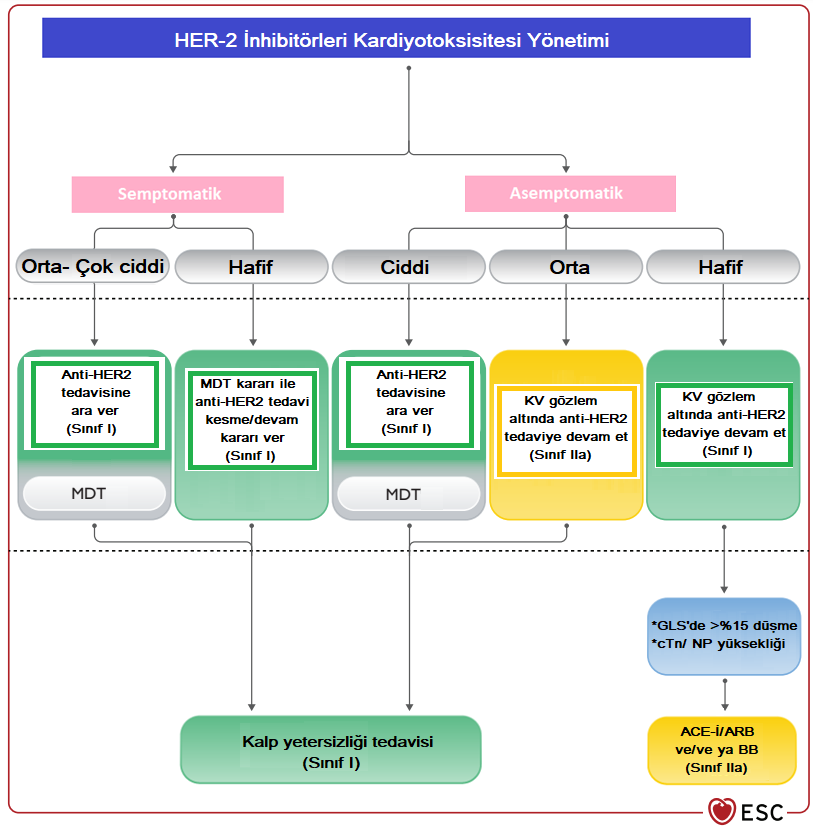
Şekil-3. HER-2 bazlı tedavi alan hastalarda kardiyotoksisite takip şeması Kısaltmalar: Post tx: Tedavi sonrası, EKG: Elektrokardiyografi, TTE: Transtorasik ekokardiyografi, cTn: Kardiyak troponin, NP: Natriüretik peptit Semptomatik kalp yetersizliği varlığında hafif evre dışında anti-HER2 tedaviye ara verilmelidir. Hafif evre semptomatik vakalarda ise multidisipliner Kardiyo-onkoloji ekibinin kararına göre hareket edilmelidir. Asemptomatik ciddi kardiyotoksisite varlığında ilaç kesilmelidir ancak orta ve hafif asemptomatik kardiyotoksisitede ACE-i/ARB ve beta blokör tedavi kombinasyonu altında anti-HER2 tedaviye yakın gözetim altında devam edilebilir (Şekil-4).
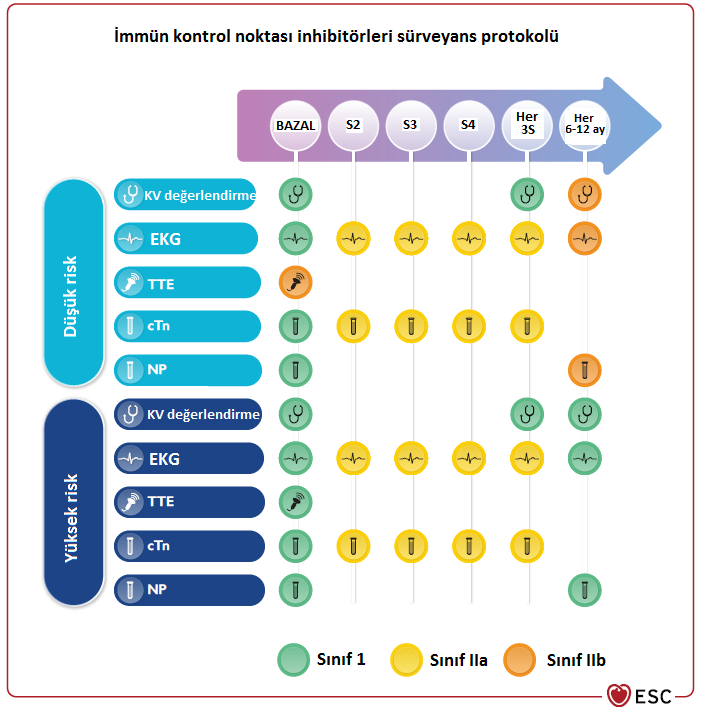
Şekil-4. HER2 inhibitörü kardiyotoksisitesi yönetimi Kısaltmalar: KV: Kardiyovasküler, MDT: Multidisipliner takım, GLS: Global longitudinalstrain, cTn: Kardiyak troponin, NP: Natriüretik peptit, ACE-İ: ACE inhibitörü, ARB: Anjiyotensin reseptör blokörü, BB: Beta blokör İmmün Kontrol Noktası İnhibitörleri İlişkili Kardiyotoksisite İmmün kontrol noktası inhibitörleri (Pembrolizumab, nivolumab vb.), immün sistemi aktive ederek kanser hücrelerine karşı olan immün yanıtta artışa neden olurlar. Hematolojik maligniteler, melanom, akciğer kanseri ve ürolojik kanserler başta olmak üzere pek çok kanser tedavisinde kullanılmaktadırlar. İmmün kontrol noktası inhibitörleri otoimmün yan etkilere neden olabilirler. Kardiyak toksisite; miyokardit, perikardit, ileti bozuklukları, aritmiler ve dislipidemi olarak prezente olabilmektedir. Miyokardit, kalp yetersizliğine progrese olabilir ve genellikle tedavinin ilk 12 haftasında ortaya çıkmakla birlikte 20. haftaya kadar miyokardit gelişen vakalar bildirilmiştir. Miyokardit tanısından genellikle izlemde gelişen EKG değişikliği ya da kardiyak enzim yüksekliği ile şüphe edilir. Miyokardit düşünülen hastalara ekokardiyografi ve kardiyak MRG yapılmalıdır. MRGde immün kontrol noktası inhibitörleri ilişkili miyokardit için spesifik bulgu olmamaklar birlikte tanıda rutin miyokardit tanısında kullanılan Lake Louise kriterleri kullanılmaktadır. PET ve endomiyokardiyal biyopsi de tanı koyma aşamasında başvurulabilecek diğer yöntemlerdir. İmmün kontrol noktası inhibitörleri ilişkili kardiyotoksisite sürveyansı Şekil-5te özetlenmiştir.
Şekil-5. İmmün kontrol noktası inhibitörleri alan hastalarda kardiyotoksisite takip şeması Kısaltmalar: S2: İkinci siklus, KV: Kardiyovasküler, EKG: Elektrokardiyografi, TTE: Transtorasik ekokardiyografi, cTn: Kardiyak troponin, NP: Natriüretik peptit İmmün kontrol noktası inhibitörleri ilişkili miyokardit geliştiği taktirde ilaç kesilmelidir. Hemodinamik olarak stabil olmayan hastalar inotropil ve mekanik destek için yoğun bakımda izlenmelidirler. Hastalar 3-5 gün boyunca iv. 500-1000 mg metilprednizolon pulse steroid tedavisi uygulanmalıdır ve yanıt değerlendirilmelidir. Steroide yanıt alınan (24-72. saatte troponin düzeyinde >%50 azalma ve EKG değişikliklerinin düzelmesi) hastalarda oral prednizolon (1 mg/kg/gün- maksimum 80mg/gün) tedavisine geçilmeli ve hastanın klinik takibine göre haftalık 10 mg doz azaltma şeması ile steroid dozu azaltılmalıdır. Steroide yanıtsız hastalarda ikinci basamak immünsüpresif ajanlar (Mikofenolat mofetil, anti-timosit globulin, tocilizumab, abatacept vb.) ve plazma değişimi tedavileri düşünülmelidir. TNF-alfa inhibitörü olan infliksimab dekompanse kalp yetersizliği varlığında verilmemelidir. CAR-T Hücre Tedavileri Kimerik antijen reseptör (CAR)- T hücre tedavileri standart tedavilere dirençli hematolojik malignitelerde kullanılan yeni tedavilerdir. İmmün kontrol noktası inhibitörleri gibi otoimmün yan etkilere neden olabilmektedirler. Kardiyotoksisite aritmiler, miyokard enfarktüsü, venöz tromboemboli ve kalp yetersizliği şeklinde ortaya çıkmaktadır ve kalp yetersizliği sıklığı %14.3 olarak bildirilmiştir. Ayrıca CAR-T hücre tedavileri, sitokin salınım sendromuna neden olarak kalp yetersizliğine neden olabilmektedir. Takotsubo Kardiyomiyopatisi Kanser hastalarında; kanserin kendisi, kanser tedavisinde kullanılan bazı ajanlar (5-flurourasil, immün kontrol noktası inhibitörleri, VEGF inhibitörleri) ve strese bağlı olarak Takotsubo kardiyomiyopatisi gelişebilir. Koroner görüntüleme ile koroner arter hastalığı ekarte edilmelidir. Etyolojik olarak şüphe edilen ajan kesilmelidir. QT uzatan ilaçlardan uzak durulmalıdır. İmmün kontrol noktası inhibitörleri ilişkili ise steroid tedavide denenebilir. Diğer Kanser Tedavileri ve Kalp Yetersizliği Antrasiklinler ve anti-HER2 tedaviler dışında kalp yetersizliği ile kardiyotoksisite yapabilen diğer kanser tedavi ajanları ve bu ajanlara bağlı kalp yetersizliği gelişme sıklığı Tablo-2de özetlenmiştir.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2008 - 2026 © Bu sitenin tüm hakları Türk Kardiyoloji Derneğine aittir. |