|
| HT Bülteni YÄḟl: 2022 SayÄḟ: 10 |
|
RenovaskÃỳler Hipertansiyon Dr. ZÃỳlkif TanrÄḟverdi, Harran Ãniversitesi TÄḟp FakÃỳltesi Kardiyoloji ABD, ÅanlÄḟurfa Dr. Aycan Fahri Erkan, Ufuk Ãniversitesi TÄḟp FakÃỳltesi Kardiyoloji ABD, Ankara Ãzet RenovaskÃỳler hipertansiyon (RVH), bir veya her iki renal arterin veya dallarÄḟnÄḟn tÄḟkanmasÄḟna baÄlÄḟ olarak geliÅen kan basÄḟncÄḟ yÃỳksekliÄi olarak tanÄḟmlanÄḟr ve anjiyotensine baÄÄḟmlÄḟ hipertansiyonun prototipidir. Sekonder ve tedaviye dirençli kan basÄḟncÄḟ yÃỳksekliÄinin en sÄḟk nedenlerinden biridir. Klinik olarak asemptomatik ve minör hipertansiyondan iskemik nefropatiye kadar deÄiÅen geniÅ bir yelpazeye sahiptir. En sÄḟk nedeni aterosklerotik lezyonlar ve fibromÃỳskÃỳler displaziye baÄlÄḟ geliÅen stenozdur. Aterosklerotik hastalÄḟÄa baÄlÄḟ RVH daha çok ileri yaÅ erkeklerde görÃỳlÃỳrken, fibromÃỳskÃỳler displaziye baÄlÄḟ RVH ise daha çok genç kadÄḟnlarda görÃỳlÃỳr. RVH için ÅÃỳpheli klinik bulgulara sahip hastalara tanÄḟsal testler uygulanmalÄḟdÄḟr. ÄḞlk sÄḟra tedavi seçeneÄi medikal tedavidir, bununla beraber seçili hastalarda renal revaskÃỳlarizasyon tedavisi ile hipertansiyondan tam kÃỳr saÄlanÄḟp sonlanÄḟmlar iyileÅtirilebilir. Bu yazÄḟdaki amacÄḟmÄḟz, RVH tanÄḟ ve tedavisi hakkÄḟndaki gÃỳncel bilgileri son geliÅmeler eÅliÄinde sunmaktÄḟr. GiriÅ RenovaskÃỳler hipertansiyon (RVH), bir veya her iki renal arterin veya dallarÄḟnÄḟn tÄḟkanmasÄḟna baÄlÄḟ olarak böbrek kan akÄḟmÄḟndaki azalma sonucu geliÅen kan basÄḟncÄḟ yÃỳksekliÄi olarak tanÄḟmlanÄḟr. Sekonder hipertansiyonun en sÄḟk nedenlerinden biridir ve tedaviye dirençli hipertansiyona neden olmaktadÄḟr (1-4). Genel hipertansif popÃỳlasyonun %1-5’ini, sekonder hipertansiyon olgularÄḟnÄḟn ise %20-40’ÄḟnÄḟ RVH oluÅturmaktadÄḟr (5,6). RVH, asemptomatik ve tesadÃỳfen saptanan bir bulgu olabileceÄi gibi, uzun vadede iskemik nefropati, kalp yetersizliÄi ve inme gibi olumsuz sonlanÄḟmlara neden olabilmektedir (7). Bu nedenle, bu hastalarÄḟn zamanÄḟnda tanÄḟnmasÄḟ ve tedavi edilmeleri önem arz etmektedir. Patofizyoloji ÄḞlk kez 1930’lu yÄḟllarda Goldblatt ve arkadaÅlarÄḟ tarafÄḟndan yapÄḟlan deneysel çalÄḟÅmalarda böbrek ve kan basÄḟncÄḟ regÃỳlasyonu arasÄḟnda temel bir baÄlantÄḟ olduÄu tespit edilmiÅ ve böbrek kan akÄḟÅÄḟndaki azalmanÄḟn sistemik kan basÄḟncÄḟnÄḟ artÄḟrdÄḟÄÄḟ gözlemlenmiÅtir (8). Bu gözlemler, renin-anjiyotensin-aldosteron-sistemi’nin (RAAS) aydÄḟnlatÄḟlmasÄḟna aracÄḟlÄḟk etmiÅtir. AzalmÄḟÅ böbrek kan akÄḟmÄḟnÄḟn (iskemik böbrek) renin salÄḟnÄḟmÄḟ aracÄḟlÄḟÄÄḟyla, anjiyotensin II ve aldosteron dÃỳzeylerinde artÄḟÅa yol açarak sÄḟrasÄḟyla vazokonstriksiyon ve su ve sodyum tutulmasÄḟna neden olduÄu gösterilmiÅtir (anjiyotensin baÄÄḟmlÄḟ hipertansiyon). DolayÄḟsÄḟyla, Goldblatt ve arkadaÅlarÄḟ renin-anjiyotensin-aldosteron-sistemi (RAAS) aktivasyonunun ve sodyum tutulumunun RVH’de önemli bir etkiye sahip olduÄu sonucuna varmÄḟÅlardÄḟr. RVH’de böbrek parankimine azalmÄḟÅ kan akÄḟmÄḟ RVH’ye neden olan RAAS aktivasyonuna neden olmaktadÄḟr. RAAS'Äḟn uzun sÃỳreli aktivasyonu, sempatik aktivasyona ve profibrotik bÃỳyÃỳme faktörlerinin artmasÄḟna neden olurken, nitrik oksit ve prostasiklin sentezinin ise azalmasÄḟna yol açar. TÃỳm bu fizyopatolojik deÄiÅiklikler kardiyak ve renal yeniden Åekillenme ve nefroskleroza yol açan iskemik böbrek hasarÄḟna neden olur (9-11). RVH patofizyolojisi darlÄḟÄÄḟn tek veya çift taraflÄḟ olmasÄḟna baÄlÄḟ olarak bazÄḟ farklÄḟlÄḟklar gösterir. Tek taraflÄḟ renal arter darlÄḟÄÄḟnda, darlÄḟk olan tarafÄḟn böbrek perfÃỳzyonu bozulur ve RAAS aktivasyonu gerçekleÅir. Bunun sonucu olarak da kan basÄḟncÄḟ anjiyotensin baÄÄḟmlÄḟ yÃỳkselir. Ancak karÅÄḟ böbrekte perfÃỳzyon normal olduÄundan dolayÄḟ sodyum ve su geri emilimi azalÄḟr, bu yÃỳzden hastalar normovolemiktir. Ancak, bilateral renal arter darlÄḟÄÄḟ veya tek fonksiyonel böbrekte renal arter darlÄḟÄÄḟ mevcut ise kompanzasyonu saÄlayacak bir böbrek olmadÄḟÄÄḟndan dolayÄḟ su ve sodyum geri emilimi artar ve bu hastalarda hipervolemi de geliÅir (6,12,13). RenovaskÃỳler Hipertansiyon Nedenleri RVH’nin en sÄḟk nedeni aterosklerotik lezyonlar ve fibromÃỳskÃỳler displaziye baÄlÄḟ renal arter stenozudur. Bununla beraber, diÄer birçok farklÄḟ nedenlere baÄlÄḟ olarak da geliÅebilir (Tablo 1) (5). Renal arter stenozu, renal arterde %50’den fazla darlÄḟk bulunmasÄḟ olarak tanÄḟmlanÄḟr ve aÄÄḟrlÄḟklÄḟ olarak aterosklerotik hastalÄḟk (%90) ve fibromÃỳskÃỳler displaziden (%10) kaynaklanÄḟr (14).
Tablo 1. RenovaskÃỳler hipertansiyon nedenleri
Aterosklerotik renal arter stenozu Daha önceden belirtildiÄi gibi renal arter stenozunun en sÄḟk nedeni aterosklerotik hastalÄḟktÄḟr. Bu hastalar genellikle primer hipertansiyon hastalarÄḟna göre daha yaÅlÄḟ olup kan basÄḟnçlarÄḟ daha yÃỳksektir ve sÄḟklÄḟkla eÅlik eden baÅka komorbid durumlar da mevcuttur. Renal arterin ostiumu ve proksimal ilk 1/3’lÃỳk kÄḟsmÄḟnda daha sÄḟk görÃỳlÃỳr. Orta derece darlÄḟklar asemptomatik olarak seyrettiÄi için aslÄḟnda gerçek prevalansÄḟ tam olarak bilinmemektedir (15). Tedaviye dirençli hipertansiyon, tekrarlayan flaÅ akciÄer ödemi ve renal fonksiyonlarda progresif bozulma olan hastalarda mutlaka akla gelmelidir. Bu hastalar esansiyel hipertansiyonlu hastalara göre daha hÄḟzlÄḟ bir Åekilde hedef organ hasarÄḟ geliÅtirirler. Aterosklerotik renal arter stenozu (ARAS) gÃỳnÃỳmÃỳzde yaÅlÄḟ hastalarda son dönem böbrek yetmezliÄinin önde gelen nedenlerinden biridir (16). FibromÃỳskÃỳler displazi FibromÃỳskÃỳler displazi (FMD), özellikle kÃỳçÃỳk ve orta bÃỳyÃỳklÃỳkteki arterleri etkileyen non-inflamatuar, non-aterosklerotik bir vaskÃỳler hastalÄḟktÄḟr. Herhangi bir vaskÃỳler yapÄḟyÄḟ etkileyebilmekle beraber, en sÄḟk tutulum yeri renal arter (en sÄḟk distal 2/3’lÃỳk kÄḟsÄḟm ve bifurkasyon bölgesi) ve serebral arterlerdir (17,18). FMD’nin en sÄḟk görÃỳlen klinik prezentasyonu RVH’dir. RVH’nin yaklaÅÄḟk %10’luk kÄḟsmÄḟndan sorumludur ve özellikle genç kadÄḟnlarda sÄḟk görÃỳlÃỳr (15-50 yaÅ). 2 alt tipi vardÄḟr: multifokal (tespih tanesi görÃỳnÃỳmÃỳ ve daha yaygÄḟn form) ve fokal (çevresel veya tÃỳbÃỳler olarak görÃỳlen nadir form). Aterosklerotik renal arter stenozundan farklÄḟ olarak nadiren son dönem böbrek yetmezliÄine ve flaÅ akciÄer ödemine neden olur (7,19). FMD saptanan hastalarda, diÄer organlardaki vaskÃỳler tutulumlar açÄḟsÄḟndan gerekli tetkikler yapÄḟlmalÄḟdÄḟr. Klinik Ãzellikler RVH hastalarÄḟnÄḟn klinik semptomlarÄḟ oldukça deÄiÅkendir. Hastalar asemptomatik ve minör hipertansiyondan iskemik nefropatiye kadar deÄiÅen progresif bir klinik yelpaze ile baÅvurabilirler. HastalarÄḟn yarÄḟsÄḟna yakÄḟn kÄḟsmÄḟna batÄḟnda anormal bir ÃỳfÃỳrÃỳm vardÄḟr, bu nedenle mutlaka batÄḟn bölgesi steteskop ile dinlenmelidir. DiÄer hastalÄḟklarÄḟn aksine, RVH’nin kesin tanÄḟsÄḟ ancak geriye dönÃỳk olarak konulabilir: tÄḟkanÄḟklÄḟk giderildikten sonra kan basÄḟncÄḟ yÃỳksekliÄinin dÃỳzelmesi. Bu nedenle, hangi hastalarda RVH’den ÅÃỳphelenilmesi gerektiÄi önemli bir durumdur (20,21). RVH dÃỳÅÃỳndÃỳren klinik özellikler Tablo 2’de sunulmaktadÄḟr.
Tablo 2. RVH dÃỳÅÃỳndÃỳren kliniksel özellikler
TanÄḟsal DeÄerlendirmeler RVH için ÅÃỳphe uyandÄḟran klinik bulgulara sahip olan bireylerde tanÄḟsal deÄerlendirme yapÄḟlmalÄḟdÄḟr. Ancak tanÄḟ için uygulanacak deÄerlendirmelere geçilmeden önce ilk olarak tanÄḟsal deÄerlendirmelerin hedefi belirlenmelidir. EÄer hastanÄḟn tedavi yönetimini deÄiÅtireceÄine inanÄḟlÄḟyorsa tanÄḟsal deÄerlendirmelere geçilmelidir. TanÄḟ yöntemleri morfolojik ve fonksiyonel olarak 2 ana gurupta incelenebilir. Renal doppler ultrasonografi, manyetik rezonans (MR) ve bilgisayarlÄḟ tomografi (BT) anjiyografi morfolojik deÄerlendirme saÄlarken, plazma renin aktivitesin (PRA) ve kaptoprilli renal sintigrafi fonksiyonel deÄerlendirme saÄlar. TanÄḟsal deÄerlendirmede bakÄḟlmasÄḟ gerekenler Åöyledir (13):
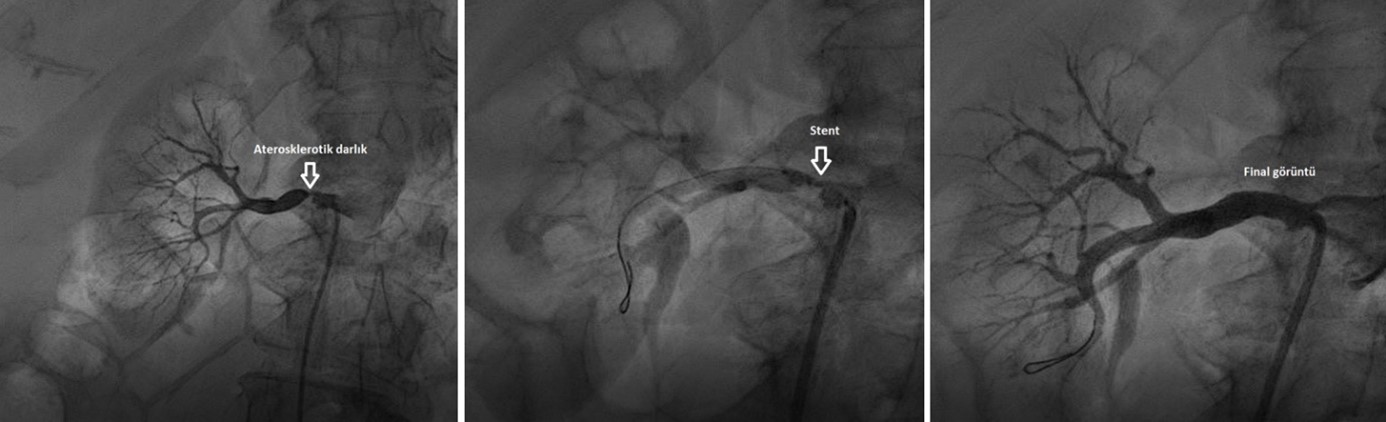
GÃỳncel kÄḟlavuzlarda RAS için tarama testi olarak önerilen ilk test doppler ultrasonografi, ardÄḟndan manyetik rezonans (MR) ve bilgisayarlÄḟ tomografi (BT) anjiyografi görÃỳntÃỳlemedir. Renal doppler ultrasonografi Non-invaziv, tekrarlanabilir ve ucuz olmasÄḟ nedeniyle en sÄḟk uygulanan görÃỳntÃỳleme yöntemidir. AynÄḟ zamanda böbrek parankimi de deÄerlendirilmektedir, bu nedenle hem fonksiyonel hem de anatomik bilgiler saÄlamaktadÄḟr. En önemli dezavantajÄḟ, operatör becerilerine gereksinim duymasÄḟ, uzun sÃỳrmesi ve obez hastalarda doÄruluk oranÄḟnÄḟn dÃỳÅÃỳk olmasÄḟdÄḟr. Doppler ultrasonografi, RAS için yaklaÅÄḟk %83 duyarlÄḟlÄḟÄa (%17-100) ve %90 özgÃỳllÃỳÄe (%63-100) sahiptir (14,22). Pik sistolik hÄḟzÄḟn 200 cm/sn'nin Ãỳzerinde olmasÄḟ %60’tan fazla bir darlÄḟk olabileceÄini gösterir. Doppler ile resisitive index ([tepe sistolik hÄḟz â diyastol sonu hÄḟz] / tepe sistolik hÄḟz) ölçÃỳmÃỳ revaskÃỳlarizasyon sonlanÄḟmlarÄḟnÄḟ öngörmede yardÄḟmcÄḟ olabilir. Genellikle, resisitive indexin <80 olmasÄḟ revaskÃỳlarizasyondan fayda saÄlanacaÄÄḟnÄḟ gösterirken, yÃỳksek resisitive index (>80) kÃỳçÃỳk damarlarÄḟn yaygÄḟn hastalÄḟÄÄḟnÄḟ gösterir ve revaskÃỳlarizasyondan faydanÄḟn az olacaÄÄḟnÄḟ öngörÃỳr (23,24). Ultrasonografi yapÄḟlamÄḟyor veya deÄerlendirme zorluÄu varsa MR veya BT anjiyografi ile deÄerlendirme dÃỳÅÃỳnÃỳlmelidir. Manyetik rezonans anjiyografi Non-invaziv bir test olmasÄḟ, radyasyon içermemesi, ileri böbrek yetmezliÄi olan hastalarda kullanÄḟlabilmesi ve potansiyel olarak nefrotoksik olan opak madde kullanÄḟmÄḟ gerektirmemesi nedeniyle son yÄḟllarda kullanÄḟmÄḟ giderek yaygÄḟnlaÅmÄḟÅtÄḟr. Gadolinyum ile görÃỳntÃỳ kalitesi arttÄḟrÄḟlmÄḟÅ olup, renal arterlerdeki anatomik lezyonlarÄḟn saptanmasÄḟnda oldukça yÃỳksek duyarlÄḟlÄḟk (%90-100) ve özgÃỳllÃỳÄe (%90-95) sahiptir (25). En önemli dezavantajÄḟ, ileri böbrek yetmezliÄi olan hastalarda (GFR <30) gadolinyuma baÄlÄḟ nefrojenik sistemik sklerozistir. 2020 yÄḟlÄḟnda yayÄḟmlanan Kanada hipertansiyon kÄḟlavuzunda GFR <30 olan hastalarda RAS tanÄḟsÄḟ için hangi tarama testinin yapÄḟlacaÄÄḟna nefroloji konsÃỳltasyonu ile karar verilmesi gerektiÄi ve bu hastalarda MR anjiyografinin kesinlikle yapÄḟlmamasÄḟ gerektiÄi belirtilmektedir (3). Ek olarak, metalik protez cihaz olanlarda MR yapÄḟlamaz ve stentleme sonrasÄḟ renal arteri deÄerlendirmek MR ile mÃỳmkÃỳn deÄildir. BilgisayarlÄḟ tomografi anjiyografi Son zamanlarda en yaygÄḟn kullanÄḟlmaya baÅlanan tarama testi haline gelen BT anjiyografi renal arter stenosunu saptamada yÃỳksek duyarlÄḟlÄḟk ve özgÃỳllÃỳÄe sahip olsa da, iÅlem sÄḟrasÄḟnda nefrotoksik olan opak madde kullanÄḟmÄḟ ve radyasyon en önemli dezantajlarÄḟdÄḟr (26). Selektif renal anjiyografi Ultrasonografi, BT ve MR tarama testleri olarak sÄḟk kullanÄḟlmalarÄḟna raÄmen bu testlerin hiçbiri RAS tanÄḟsÄḟnda tamamen kusursuz deÄildir. EÄer bu testlerde RAS açÄḟsÄḟndan ÅÃỳphe saptanmÄḟÅsa veya bu testler yetersiz kalmÄḟÅsa hem Amerikan hem de Avrupa kÄḟlavuzlarÄḟnda altÄḟn standart tanÄḟ yöntemi olarak önerilen selektif renal anjiyografi uygulanmalÄḟdÄḟr (1,2,26). KardiyovaskÃỳler anjiyografi ve mÃỳdahaleler derneÄi (SCAI), anjiyografik olarak darlÄḟÄÄḟn %50’den az olmasÄḟnÄḟ hafif, %50-70 arasÄḟnda olmasÄḟnÄḟ orta, %70 Ãỳzerinde olmasÄḟnÄḟ ise kritik olarak kabul etmektedir (22). Buna karÅÄḟn, Avrupa kÄḟlavuzunda hemodinamik olarak anlamlÄḟ RAS için belirtilen sÄḟnÄḟr deÄer %60 olarak belirtilmektedir. Anjiyografinin en önemli dezavantajlarÄḟ, fonksiyonel bir deÄerlendirme saÄlamamasÄḟ ve opak madde kaynaklÄḟ nefrotoksisite riskidir. Plazma renin aktivitesi ve Kaptoprilli renal sintigrafi Renin dÃỳzeyi kolay bir Åekilde ölçÃỳlebilir ancak bilateral renal arter stenozu olan hastalarda renin dÃỳzeyi yÃỳkselmeyebilir. DahasÄḟ, RVH’li hastalarÄḟn %20’ye yakÄḟnÄḟnda renin dÃỳzeyi normal olarak saptanabilirken, esansiyel hipertansiyonlu bazÄḟ hastalarda da renin dÃỳzeyi yÃỳksek olarak saptanabilir (27,28). Kaptoprilli renal sintigrafinin tanÄḟ kapasitesi (duyarlÄḟlÄḟk: %45â94, özgÃỳllÃỳk: %81â100) BT ve MR anjiyografiye göre daha dÃỳÅÃỳktÃỳr, ancak intrarenal kan akÄḟmÄḟ, fonksiyonel deÄerlendirme ve saÄ/sol böbrek fonksiyonlarÄḟ hakkÄḟnda ayrÄḟntÄḟlÄḟ deÄerlendirme saÄlamaktadÄḟr. 25 mg Kaptopril kullanÄḟmÄḟ darlÄḟk olan tarafta anjiyotensin II’ye baÄlÄḟ artmÄḟÅ efferent arterioler direnci dÃỳÅÃỳrÃỳr, böylece intraglomerÃỳler basÄḟnçta ve GFR’de ciddi dÃỳÅÃỳÅlere yol açar (29). Bu tanÄḟsal yöntemler, morfolojik temelli tanÄḟsal deÄerlendirme için uygun deÄillerdir ve sadece fonksiyonel deÄerlendirme amaçlÄḟ yapÄḟlmalÄḟdÄḟr. KÄḟlavuzlarda bu testlerin tarama testi olarak kullanÄḟlmasÄḟ önerilmemektedir (SÄḟnÄḟf 3). Tedavi RVH tedavisi altta yatan etiyolojik nedene, kan basÄḟncÄḟ yÃỳksekliÄinin Åiddetine, klinik belirtilere ve böbrek fonksiyonlarÄḟndaki bozukluÄa göre farklÄḟlÄḟk göstermektedir. Tedavinin amacÄḟ, renin yÃỳksekliÄine baÄlÄḟ artmÄḟÅ kan basÄḟncÄḟnÄḟn kontrolÃỳ ve darlÄḟÄa baÄlÄḟ olarak oluÅan renal iskemiyi dÃỳzeltmektir (13,19,22). ÄḞlk tedavi seçeneÄi olarak, tÃỳm kÄḟlavuzlarda yaÅam tarzÄḟ deÄiÅiklikleri ve medikal tedavi önerilmektedir (1,-3,22,27). SeçilmiÅ hastalarda stentli veya stentsiz perkÃỳtan translÃỳminal renal anjiyoplasti ve cerrahi tedavi seçenekleri de mevcuttur. YaÅam tarzÄḟ deÄiÅiklikleri Hipertansiyon tedavisinde konvansiyonel olarak uygulanan yaÅam tarzÄḟ deÄiÅiklikleri kan basÄḟncÄḟ kontrolÃỳnde önemli bir rol oynar. RVH hastalarÄḟnda da sigaranÄḟn bÄḟrakÄḟlmasÄḟ, dÃỳzenli egzersiz, az tuzlu-tuzsuz diyet ve kilo verilmesi daha iyi kardiyovaskÃỳler sonlanÄḟmlarla iliÅkilidir (7). Medikal tedavi RVH hastalarÄḟnda efektif ilaç tedavisi hakkÄḟnda net veriler olmasa da medikal tedavi yönetimi; statin, antiplatelet, hasta diyabetik ise anti-diyabetik ve antihipertansif ilaç Åeklinde olmalÄḟdÄḟr (30,31). Daha önce hiçbir randomize klinik çalÄḟÅmada antihipertansif ilaç sÄḟnÄḟflarÄḟ arasÄḟnda bir karÅÄḟlaÅtÄḟrma yapmamÄḟÅ olmasÄḟna raÄmen, renal arter darlÄḟÄÄḟnÄḟn RAAS’Äḟ aktive etmesi nedeniyle bu hastalarda verilmesi gereken ilk sÄḟradaki antihipertansif ilaçlar RAAS blokerleri (ACE-inhibitörleri ve ARB’ler) olmalÄḟdÄḟr (tek taraflÄḟ darlÄḟk olanlar için önerilir, çift taraflÄḟ darlÄḟk varsa kontrendikedirler) (27,32). Bu ilaçlarÄḟn, anjiyoplasti yapÄḟlÄḟp yapÄḟlmasÄḟna bakÄḟlmaksÄḟzÄḟn RAAS aktivasyonuna baÄlÄḟ geliÅecek kardiyovaskÃỳler ve renal prognozu iyileÅtirdiÄi ve kalp yetmezliÄine baÄlÄḟ hastane yatÄḟÅÄḟnÄḟ azalttÄḟÄÄḟ gösterilmiÅtir (33,34). Bu nedenle, RVH hastalarÄḟnda RAAS blokerlerinin kullanÄḟmÄḟ dÃỳÅÃỳnÃỳlmelidir. Yine de, ilaç baÅlanÄḟrken dÃỳÅÃỳk dozda baÅlanmalÄḟ ve tedavi baÅlanmasÄḟ sonrasÄḟ renal fonksiyonlar yakÄḟn takip edilmelidir. EÄer, ACE-inhibitörleri ve ARB’ler ile kan basÄḟncÄḟ regÃỳlasyonu saÄlanmÄḟÅ ve renal fonksiyonlar stabil olarak kalmÄḟÅsa ek bir tedaviye gerek duyulmaz. EÄer bu ilaçlar kan basÄḟncÄḟ regÃỳle edilemezse veya böbrek fonksiyonlarÄḟna bozulma meydana gelirse, tiyazid diÃỳretikler, kalsiyum kanal blokerleri, mineralokortikoid reseptör antagonistleri ve beta blokörler dÃỳÅÃỳnÃỳlmelidir (27). Medikal tedavi, ARAS hastalarÄḟnda tedavinin en önemli basamaÄÄḟnÄḟ oluÅturmaktadÄḟr. Ancak, hiçbir randomize kontrollÃỳ çalÄḟÅma tek baÅÄḟna medikal tedaviye kÄḟyasla renal anjiyoplastinin yerleÅik tedavi edici etkisini göstermemiÅtir (30,31,35,36). Bu nedenle, tedavi yönteminin nasÄḟl olacaÄÄḟna hastanÄḟn bireysel durumuna göre karar verilmeli ve medikal tedaviden sonra böbrek fonksiyonlarÄḟnda bozulma olan hastalarda revaskÃỳlarizasyon seçeneÄi akÄḟlda tutulmalÄḟdÄḟr. PerkÃỳtan translÃỳminal renal anjiyoplasti PerkÃỳtan tedavinin amacÄḟ, kan basÄḟncÄḟnÄḟ kontrol altÄḟna almak, böbrek yetmezliÄinin önlenmesi/ilerlemesinin yavaÅlatÄḟlmasÄḟ ve kardiyovaskÃỳler sonlanÄḟmlarÄḟn iyileÅtirilmesidir. FMD hastalarÄḟ için stentsiz perkÃỳtan renal anjiyoplasti önerilmektedir ve genellikle tedaviye iyi yanÄḟt verirler. Teknik baÅarÄḟ oranÄḟ %90’a yakÄḟndÄḟr (%83-100), ancak 1 yÄḟl içerisinde yaklaÅÄḟk %10 hastada (%5-11) restenoz geliÅebilmektedir (14). Balon anjiyoplasti ile baÅarÄḟlÄḟ tedaviye raÄmen hastalarÄḟn sadece 1/3’Ãỳnde tam kÃỳr saÄlanmaktadÄḟr (tÃỳm antihipertansif ilaçlarÄḟn kesilmesi). Ãzellikle de genç bayanlarda, kÄḟsa sÃỳreli hipertansiyon öykÃỳsÃỳ olanlar, ana renal arterde lezyonlarÄḟ olanlar ve komorbid durumlarÄḟ olmayan hastalarda baÅarÄḟ ÅansÄḟ daha yÃỳksektir (37). Bu nedenle özellikle komorbiditesi olmayan genç FMD hastalarÄḟnda hipertansyion sÃỳresi uzamadan erken dönemde anjiyoplasti yapÄḟlmasÄḟ dÃỳÅÃỳnÃỳlebilir. ARAS hastalarÄḟnÄḟn tedavisi FMD’den farklÄḟlÄḟk göstermektedir, çÃỳnkÃỳ sadece anjiyoplasti tedavisi genellikle bu hastalarda açÄḟklÄḟÄÄḟ saÄlamada yetersiz kalmaktadÄḟr. Ãzellikle de osteal ve proksimaldeki lezyonlar da elastik recoile baÄlÄḟ olarak restenoz oranÄḟ yÃỳksektir. Bu nedenle, ARAS hastalarÄḟnda sÄḟklÄḟkla stent uygulamasÄḟ gerekmektedir. Ancak stent uygulanmasÄḟna raÄmen, özellikle de 5mm altÄḟndaki damarlarda restenoz oranÄḟ yine %20’lere kadar görÃỳlebilmektedir (38).  Anjiyoplastiden sonra maksimum antihipertansif etkinlik genellikle 48 saat sonra görÃỳlÃỳr (39). Komplikasyon olarak, kontrast nefropatisi, kanama, renal arter diseksiyonu, emboli, infarkt, total oklÃỳzyon, perforasyon ve diyaliz gerektiren akut böbrek hasarÄḟ geliÅebilir (11). KliniÄimizde aterosklerotik renal arter darlÄḟÄÄḟ nedeniyle stent implante ettiÄimiz bir hastaya ait iÅlem öncesi ve iÅlem sonrasÄḟ görÃỳntÃỳler Åekil 1’de gösterilmektedir.
Åekil 1. KliniÄimizde ciddi semptomatik renal arter darlÄḟÄÄḟ bulunan bir hastanÄḟn perkÃỳtan translÃỳminal renal anjiyoplasti ve stentleme ile baÅarÄḟlÄḟ tedavisi. RAS hastalarÄḟ için perkÃỳtan anjiyoplasti önerilerine kÄḟlavuzlar açÄḟsÄḟndan bakÄḟldÄḟÄÄḟnda bazÄḟ farklÄḟlÄḟklar göze çarpmaktadÄḟr. Her iki kÄḟlavuzda da hemodinamik olarak anlamlÄḟ olan lezyonlara mÃỳdahale edilmesi gerektiÄi vurgulansa da giriÅim için bazÄḟ özelliklere bakÄḟlmasÄḟ gerektiÄi belirtilmektedir. Amerikan ve Avrupa kÄḟlavuzunda revaskÃỳlarizasyon önerileri Tablo 3 ve Tablo 4’te gösterilmektedir (40,41). Tablolardan da görÃỳleceÄi gibi her iki kÄḟlavuz arasÄḟnda uygulama açÄḟsÄḟndan oldukça farklÄḟlÄḟklar görÃỳlmektedir. YakÄḟn zamanda yayÄḟmlanan Kanada ve Japonya hipertansiyon kÄḟlavuzlarÄḟna bakÄḟldÄḟÄÄḟnda, bu kÄḟlavuzlarda da RVH hastalarÄḟ için revaskÃỳlarizasyon önerilerinin sunulduÄu görÃỳlmektedir. Kanada kÄḟlavuzundaki öneriler Åu Åekildedir: (I) ARAS olan hastalar öncelikle tÄḟbbi tedavi ile takip edilmelidir, çÃỳnkÃỳ anjiyoplasti/stentlemenin tek baÅÄḟna medikal tedaviye göre ÃỳstÃỳnlÃỳÄÃỳ yoktur, (II) anjiyoplasti/stentleme sadece hemodinamik olarak ciddi olan RAS hastalarÄḟnda ve maksimum tedaviye raÄmen dirençli hipertansiyon, akut pulmoner ödem veya progresif renal fonksiyon bozukluÄu olan hastalarda uygulanmalÄḟdÄḟr, (III) FMD hastalarÄḟnda bail-out stentlemeli balon anjiyoplasti yapÄḟlmalÄḟdÄḟr. Japonya kÄḟlavuzundaki revaskÃỳlarizasyon önerilerine bakÄḟldÄḟÄÄḟnda ise; (I) FMD, (II) dirençli hipertansiyon, (III) malign hipertansiyon, (IV) açÄḟklanamayan veya tekrarlayan pulmoner ödem/kalp yetmezliÄi, (V) bilateral RAS veya soliter böbrekte RAS varlÄḟÄÄḟ.
Tablo 3. Amerika kÄḟlavuzunda RAS için revaskÃỳlarizasyon önerileri (40)
Tablo 4. Avrupa kÄḟlavuzunda RAS için revaskÃỳlarizasyon önerileri (41)
RAS hastalarÄḟnda, medikal tedavi ile perkÃỳtan revaskÃỳlarizasyon tedavisini karÅÄḟlaÅtÄḟran 3 randomize kontrollÃỳ çalÄḟÅma mevcuttur: CORAL (Cardiovascular Outcome for Renal Artery Lesions (30), ASTRAL (Angioplasty and Stenting for Renal Atherosclerotic Lesions) (31) ve STAR (Stent Placement in Patients With Atherosclerotic Renal Artery Stenosis and Impaired Renal Function) (42). Bu 3 randomize çalÄḟÅma da, tek baÅÄḟna tÄḟbbi tedaviye karÅÄḟn endovaskÃỳler tedavinin kan basÄḟncÄḟ kontrolÃỳ ve renal ve kardiyovaskÃỳler sonlanÄḟmlar Ãỳzerinde kesin yararÄḟnÄḟ göstermede baÅarÄḟsÄḟz olmuÅlardÄḟr. Bu nedenle, tÃỳm gÃỳncel kÄḟlavuzlarda RAS tedavisinde ilk tedavi seçeneÄi olarak medikal tedavi halen yer almaktadÄḟr ve sadece belirlenmiÅ hasta gruplarÄḟnda revaskÃỳlarizasyon tedavisi önerilmektedir. Bununla beraber, belirtilen 3 çalÄḟÅmada da yÃỳksek riskli hastalar aslÄḟnda yeterince temsil edilememiÅlerdir (hÄḟzlÄḟ ilerleyen böbrek yetmezliÄi, RAAS blokerleri sonrasÄḟ böbrek hasarÄḟ, dirençli hipertansiyon, tekrarlayan flaÅ akciÄer ödemi olan hastalar vs.). RevaskÃỳlarizasyon tedavisinden esasen bu hastalarÄḟn fayda göreceÄi dÃỳÅÃỳnÃỳldÃỳÄÃỳnde, bu randomize çalÄḟÅmalarÄḟn sonuçlarÄḟ dikkatle yorumlanmalÄḟdÄḟr (19). RevaskÃỳlarizasyon tedavisinin kararÄḟ multidispliner bir yaklaÅÄḟmla alÄḟnmalÄḟ ve hastalar dikkatle seçilmelidir. Klinisyenler, revaskÃỳlarizasyon tedavisinden fayda görebilecek bu alt gurubu belirlemeli ve uygun Åekilde mÃỳdahale etmelidirler. PerkÃỳtan revaskÃỳlarizasyon tedavisinin olumlu yanÄḟt olabileceÄini tahmin edebilmek için kullanÄḟlacak kriterler Tablo 5’te gösterilmektedir (7,14,20,22). Klinik olarak hafif dereceli darlÄḟklarda (<%60) ve renal arterin tam tÄḟkalÄḟ olduÄu durumlarda (%100) ise revaskÃỳlarizasyon önerilmemektedir.
Tablo 5. RevaskÃỳlarizasyonun faydalÄḟ/faydasÄḟz olabileceÄini gösteren klinik belirteçler
Cerrahi tedavi EndovaskÃỳler yöntemlerin gÃỳnlÃỳk pratiÄe girmesinden önce uygulanan cerrahi tedavi, gÃỳnÃỳmÃỳzde artÄḟk sadece perkÃỳtan tedavilerin uygulanamadÄḟÄÄḟ (kompleks anevrizmalar, kompleks lezyonlar [bifurkasyon-distal dallar]) veya baÅarÄḟsÄḟz olduÄu RVH hastalarÄḟnda uygulanmaktadÄḟr (13,43). RVH tedavisinde temel olarak kullanÄḟlan cerrahi tedaviler: nefrektomi, endarterektomi ve aortorenal bypass’tÄḟr. Cerrahi tedavi ile ilgili kÄḟlavuz önerilerine bakÄḟldÄḟÄÄḟnda, Amerikan kÄḟlavuzunda Åu durumlarda SÄḟnÄḟf 1 öneri ile cerrahi tedavi önerilmektedir (40): (I) VaskÃỳler cerrahi rekonstrÃỳksiyon, giriÅim endikasyonu bulunan ancak kompleks lezyonlara sahip (segmental arterlerin tutulumu, makroanevrizma varlÄḟÄÄḟ) FMD'li RAS hastalarÄḟnda uygulanmalÄḟdÄḟr, (II) vaskÃỳler cerrahi rekonstrÃỳksiyon, giriÅim endikasyonu bulunan ancak birden fazla kÃỳçÃỳk renal arteri olan veya ana renal arterde erken bifurkasyona sahip olan ARAS hastalarÄḟnda uygulanmalÄḟdÄḟr, (III) cerrahi olarak tedavi edilecek aortik anevrizma veya ciddi aortoiliak oklÃỳziv hastalÄḟÄÄḟ bulunan hastalarda ARAS mevcut ise vaskÃỳler cerrahi rekonstrÃỳksiyon yapÄḟlmalÄḟdÄḟr. Avrupa kÄḟlavuzunda ise kompleks renal anatomili hastalarda baÅarÄḟsÄḟz bir endovaskÃỳler prosedÃỳrden sonra veya açÄḟk aort cerrahisi sÄḟrasÄḟnda cerrahi revaskÃỳlarizasyon dÃỳÅÃỳnÃỳlmesi gerektiÄi belirtilmektedir (41). Sonuç RVH, genel hipertansif popÃỳlasyonun %1-5’ini, sekonder hipertansiyon olgularÄḟnÄḟn ise %20-40’ÄḟnÄḟ oluÅturmaktadÄḟr. Medikal tedaviye dirençli, tekrarlayan akciÄer ödemi ve RAAS blokerleri sonrasÄḟ renal fonksiyonlarÄḟnda kötÃỳleÅme olan hastalarda akla gelmelidir. Hayat tarzÄḟ deÄiÅiklikleri ve medikal tedavi ilk sÄḟrada uygulanacak tedavidir. Medikal tedaviye raÄmen semptomatik olan hastalarda revaskÃỳlarizasyon tedavisi dÃỳÅÃỳnÃỳlebilir, ancak revaskÃỳlarizasyonun faydalÄḟ olmasÄḟ için hastalar uygunluk açÄḟsÄḟndan ayrÄḟntÄḟlÄḟ bir Åekilde deÄerlendirilmelidir. Sistematik bir yaklaÅÄḟm ile erken tanÄḟ ve tedavi, RVH’ye baÄlÄḟ olumsuz sonuçlarÄḟn önlenmesinde önemli bir rol oynayacaktÄḟr.
KAYNAKLAR 1- Williams B, Mancia G, Spiering W, et al; List of authors/Task Force members:. 2018 Practice Guidelines for the management of arterial hypertension of the European Society of Hypertension and the European Society of Cardiology: ESH/ESC Task Force for the Management of Arterial Hypertension. J Hypertens. 2018;36(12):2284-309. 2- Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2018;71(19):e127-e248. 3- Rabi DM, McBrien KA, Sapir-Pichhadze R, et al. Hypertension Canada's 2020 Comprehensive Guidelines for the Prevention, Diagnosis, Risk Assessment, and Treatment of Hypertension in Adults and Children. Can J Cardiol. 2020;36(5):596-624. 4- Textor SC, Lerman L. Renovascular hypertension and ischemic nephropathy. Am J Hypertens 2010;23(11):1159â69. 5- Puar TH, Mok Y, Debajyoti R, et al. Secondary hypertension in adults. Singapore Med J. 2016;57(5):228-32. 6- Gaspar MA. Renovascular hypertension: The current approach. Rev Port Cardiol (Engl Ed). 2019;38(12):869-871. 7- Mannemuddhu SS, Ojeda JC, Yadav A. Renovascular Hypertension. Prim Care. 2020;47(4):631-44. 8- Goldblatt H, Lynch J, Hanzal RF, et al. Studies on experimental hypertension: I. The production of persistent elevation of systolic blood pressure by means of renal ischemia. J Exp Med. 1934;59:347â79. 9- Fernando D, Garasic J. Percutaneous intervention for renovascular disease: rationale and patient selection. Curr Opin Cardiol 2004;19(6):582â8. 10- Rossignol P, Chatellier G, Azizi M, et al. Proteinuria in renal artery occlusion is related to active renin concentration and contralateral kidney size. J Hypertens 2002;20:139-44 11- Boutari C, Georgianou E, Sachinidis A, et al. Renovascular Hypertension: Novel Insights. Curr Hypertens Rev. 2020;16(1):24-29. 12- Martinez-Maldonado M. Pathophysiology of renovascular hypertension. Hypertension. 1991;17(5):707-19. 13- YÄḟldÄḟz S, YaylalÄḟ YT. RenovaskÃỳler Hipertansiyon. Turkiye Klinikleri J Cardiovasc Sci 2012;24(3):206-12 14- Elliott WJ. Renovascular hypertension: An update. J Clin Hypertens 2008;10:522-33. 15- Drieghe B, Madaric J, Sarno G, et al. Assessment of renal artery stenosis: sideby-side comparison of angiography and duplex ultrasound with pressure gradient measurements. Eur Heart J 2008;29:517â24 16- Schoepe R, McQuillan S, Valsan D, et al. Atherosclerotic Renal Artery Stenosis. Adv Exp Med Biol. 2017;956:209-13. 17- Sanidas EA, Seferou M, Papadopoulos DP, et al. Renal fibromuscular dysplasia: a not so common entity of secondary hypertension. J Clin Hypertens. 2016;18: 240â6. 18- Olin JW, Gornik HL, Bacharach JM, et al. Fibromuscular dysplasia: state of the science and critical unanswered questions: a scientific statement from the American Heart Association. Circulation 2014;129:1048â78. 19- Herrmann SM, Textor SC. Renovascular Hypertension. Endocrinol Metab Clin North Am. 2019;48(4):765-778. 20- Textor SC. Renal arterial disease and hypertension. Med Clin North Am 2017; 101(1):65â79. 21- Nair R, Vaqar S. Renovascular Hypertension. 2022 May 23. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Janâ. 22- Parikh SA, Shishehbor MH, Gray BH, et al. SCAI expert consensus statement for renal artery stenting appropriate use. Catheter Cardiovasc Interv. 2014 1;84(7):1163-71. 23- Radermacher J, Chavan J, Bleck J, et al. Use of Doppler ultrasound to predict the outcome of therapy for renal artery stenosis. N Engl J Med. 2001;344:410â417. 24- Bolduc JP, Oliva VL, Therasse E, et al. Diagnosis and treatment of renovascular hypertension: a cost-benefit analysis. AJR Am J Roentgenol. 2005;184:931â937. 25- Postma CT, Joosten FB, Rosenbusch G, et al. Magnetic resonance angiography has a high reliability in the detection of renal artery stenosis. Am J Hypertens 1997; 10: 957. 26- Lao D, Parasher PS, Cho KC, et al. Atherosclerotic renal artery stenosis-diagnosis and treatment. Mayo Clin Proc 2011; 86: 64957. 27- Umemura S, Arima H, Arima S, et al. The Japanese Society of Hypertension Guidelines for the Management of Hypertension (JSH 2019). Hypertens Res. 2019;42(9):1235-481. 28- Wilcox CS. Use of angiotensin-converting-enzyme inhibitors for diagnosing renovascular hypertension. Kidney Int. 1993;44:1379â90. 29- Dondi M. Captopril renal scintigraphy with 99mTc-mercaptoacetyltriglycine (99mTcMAG3) for detecting renal artery stenosis. Am J Hypertens 1991;4(12 Pt 2):737-40. 30- Cooper CJ, Murphy TP, Cutlip DE, et al; CORAL Investigators. Stenting and medical therapy for atherosclerotic renal-artery stenosis. N Engl J Med. 2014 Jan 2;370(1):13-22. 31- ASTRAL Investigators, Wheatley K, Ives N, Gray R, et al. Revascularization versus medical therapy for renal-artery stenosis. N Engl J Med. 2009;361(20):1953-62. 32- Unger T, Borghi C, Charchar F, et al. 2020 International Society of Hypertension Global Hypertension Practice Guidelines. Hypertension. 2020;75(6):1334â57. 33- Hackam DG, Spence JD, Garg AX, et al. Role of renin-angiotensin system blockade in atherosclerotic renal artery stenosis and renovascular hypertension. Hypertension. 2007;50(6):998-1003. 34- Losito A, Errico R, Santirosi P, et al. Long-term follow-up of atherosclerotic renovascular disease. Beneficial effect of ACE inhibition. Nephrol Dial Transplant. 2005;20(8):1604-9. 35- Jenks S, Yeoh SE, Conway BR. Balloon angioplasty, with and without stenting, versus medical therapy for hypertensive patients with renal artery stenosis. Cochrane Database Syst Rev. 2014;2014(12):CD002944. 36- Riaz IB, Husnain M, Riaz H, et al. Meta-analysis of revascularization versus medical therapy for atherosclerotic renal artery stenosis. Am J Cardiol. 2014;114(7):1116-23. 37- Slovut DP, Olin JW. Current concepts: Fibromuscular dysplasia. N Engl J Med. 2004;350:1862â71. 38- Textor SC, Misra S, Oderich GS. Percutaneous revascularization for ischemic nephropathy: the past, present, and future. Kidney Int 2013;83:28â40 39- Bonelli FS, McKusick MA, Textor SC, et al. Renal artery angioplasty: Technical results and clinical outcome in 320 patients. Mayo Clin Proc 1995; 70: 1041 40-Rooke TW, Hirsch AT, Misra S, et al; American College of Cardiology Foundation Task Force; American Heart Association Task Force. Management of patients with peripheral artery disease (compilation of 2005 and 2011 ACCF/AHA Guideline Recommendations): a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2013 Apr 9;61(14):1555-70. 41- Aboyans V, Ricco JB, Bartelink MEL, et al; ESC Scientific Document Group. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018 Mar 1;39(9):763-816. 42- Bax L, Mali W, Buskens E, et al. The benefit of stent placement and blood pressure and lipid-lowering for the prevention of progression of renal dysfunction caused by atherosclerotic ostial stenosis of the renal artery. the star-study: rationale and study design. J Nephrol. 2003;16(6):807â12 43- Bax L, Mali WP, Van De Ven PJ, et al. Repeated intervention for in-stent restenosis of the renal arteries. J Vasc Interv Radiol 2002; 13: 1219-24 |
| 2026 © Bu sitenin tüm haklarý Türk Kardiyoloji Derneŵine aittir. |